|
|
МЕНЮ
|
Дипломная работа: Параметры функционирования митоКАТФ у животных с различной устойчивостью к гипоксии, а также у крыс, адаптированных к кислородному голоданиюВыброс калия из МХ при адаптации животных к гипоксии за счет интенсификации К+/Н+-обменника при активации митоКАТФ позволяет поддерживать постоянный объем МХ и, вероятно, необходим для адаптации животных к гипоксии. Возможно, при адаптации низкоустойчивых животных к гипоксии важное значение имеет активация не только системы АТФ-зависимого входа К+ в мтиохондрии, но и системы выхода этого иона. При этом снижение активности К+/Н+-обменника может быть причиной высокоамплитудного набухания и следующего за ним повреждения МХ при ишемии.
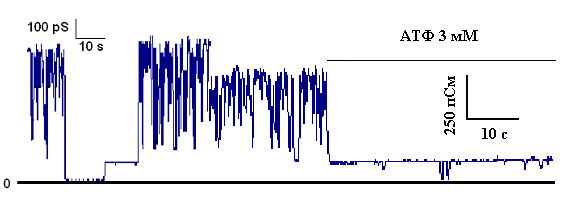
Измерения проводились при постоянном перемешивании и термостатировании при 26°С. Условия как на рис. 10. Известно, что при гипоксии недостаток кислорода приводит к восстановлению переносчиков дыхательной цепи, поскольку сток электронов на кислород затруднен [Лукьянова, 2004]. В соответствии с литературными данными восстановление переносчиков, локализованных на I и III комплексах дыхательной цепи, приводит к увеличению образования активных форм кислорода (АФК) [Kaplan-Bresler, 1965; Ferranti et al., 2003]. Как было показано ранее, главным участком образования АФК являются связанные с белком убисемихиноны, которые сопряжены по спину с железо-серным кластером [Ohnishi et al., 2005]. МХ превращают несколько процентов потребляемого кислорода в АФК [Lenaz et al., 2002]. Как было показано ранее, небольшие концентрации АФК необходимы для функционирования дыхательной цепи [Kondrashova and Mironova, 1971]. В то же время, повышенное образование АФК при гипоксии служит основным повреждающим фактором [Starkov et al., 1997; Barger et al., 2002]. Обнаруженная нами активация калиевого цикла, способствует слабому разобщению митохондрий и снижению мембранного потенциала. Известно, что незначительное снижение мембранного потенциала (~13%) ведет к существенному уменьшению продукции АФК (до 80%) [Korshunov et al., 1997]. Кроме того, было установлено, что активация канала сопровождается снижением концентрации АФК в клетке, способствуя сохранению уровня АТФ [Zweier et al., 1987; Pain et al., 2000]. Этот предполагаемый механизм может объяснить защитную роль митоКАТФ канала при реперфузии. Хорошо известно, что АФК являются основным повреждающим фактором при ишемии/реперфузии [Pearlstein et al., 2002; Li et al., 2002], а активация митоКАТФ канала приводит к сокращению уровня образования АФК во время фазы реперфузии [Zweier et al., 1987; Ozcan et al., 2002]. Полученные данные подтверждают развиваемую в лаборатории проф. Лукьяновой концепцию, что адаптация к гипоксии идет на фоне снижения свободнорадикальной активности, а не ее увеличения [Лукьянова, 2004]. Таким образом, полученные в работе результаты позволили доказать важную роль митоКАТФ в формировании устойчивости организма к кислородному голоданию, а также в адаптации животных к гипоксии. В работе предлагается также возможный механизм формирования такого типа адаптации. 5.2 Изучение структурной организации митохондриального АТФ-зависимого калиевого канала Изучение структурной организации митоКАТФ, учитывая его существенную физиологическую роль, особенно при гипоксии, является актуальной проблемой. Как было сказано в «Обзоре литературы», японские ученые полагают, что по структуре он близок к цитоплазматическому каналу [Suzuki et al., 1997]. Однако, проведенный в лаборатории проф. Гарлида анализ действия АТ к цито-KIR на АТФ-зависимый транспорт К+ в МХ не подтвердил эти данные [Grover and Garlid, 2000]. С другой стороны, в группе проф. Марбана было высказано предположение о том, что канал образован мультикомплексом, сосоящим из 5 МХ белков, одним из которых является АВС [Ardehali et al., 2004].Следовательно, структурная организация МХ АТФ-зависимого калиевого канала до настоящего времени окончательно не выяснена. 5.2.1 Определение гомологии белка с м.м. 55 кДа методом MS-MALDI-TOF/TOF Первым этапом изучения белка с м.м. 55 кДа было определение гомологичности его структуры последовательностям известных белков. Для этого электрофоретически чистый белок исследовали MS-MALDI-TOF/TOF (от англ. mass spectrometry-matrix assisted laser desorbtion/ionization – time of flight/time of flight) анализом. Согласно данным, полученным MS-MALDI-TOF/TOF анализом, белок с м.м. 55 кДа на 54% гомологичен белку-предшественнику, который, исходя из результатов анализа базы данных NCBI (программное обеспечение - MASCOT (MartixScience, Москва)), является предшественником кальретикулина. Вероятно, белок с м.м. 55 кДа является конечным продуктом систем посттрансляционной модификации данного белка-предшественника. На рисунке 14 представлена аминокислотная последовательность белка-предшественника. Последовательности данного белка, перекрывающиеся с последовательностями 55 кДа белка, выделены серым цветом. 1 MLLSVPLLLG LLGLAAADPA IYFKEQFLDG DAWTNRWVES KHKSDFGKFV 51 LSSGKFYGDQ EKDKGLQTSQ DARFYALSAR FEPFSNKGQT LVVQFTVKHE 101 QNIDCGGGYV KLFPGGLDQK DMHGDSEYNI MFGPDICGPG TKKVHVIFNY 151 KGKNVLINKD IRCKDDEFTH LYTLIVRPDN TYEVKIDNSQ VESGSLEDDW 201 DFLPPKKIKD PDAAKPEDWD ERAKIDDPTD SKPEDWDKPE HIPDPDAKKP 251 EDWDEEMDGE WEPPVIQNPE YKGEWKPRQI DNPDYKGTWI HPEIDNPEYS 301 PDANIYAYDS FAVLGLDLWQ VKSGTIFDNF LITNDEAYAE EFGNETWGVT 351 KAAEKQMKDK QDEEQRLKEE EEDKKRKEEE EAEDKEDEDD RDEDEDEEDE 401 KEEDEEDATG QAKDEL Рис.12. Аминокислотная последовательность прекурсорного белка. Участки структуры белка-предшественника, совпадающие с последовательностями, имеющимися в белке с м.м. 55 кДа, выделены серым цветом При рассмотрении структуры типичного кальретикулина, выделенного из печени крысы, процент перекрывания его аминокислотных последовательностей с известными последовательностями 55 кДа белка также оказался достаточно большим (Рис.13). 1 mllsvplllg llglaaadpa iyfkeqfldg dawtnrwves khksdfgkfv 51 lssgkfygdq ekdkglqtsq darfyalsar fepfsnkgqt lvvqftvkhe 101 qnidcgggyv klfpggldqk dmhgdseyni mfgpdicgpg tkkvhvifny 151 kgknvlinkd irckddefth lytlivrpdn tyevkidnsq vesgsleddw 201 dflppkkikd pdaakpedwd erakiddptd skpedwdkpe hipdpdakkp 251 edwdeemdge weppviqnpe ykgewkprqi dnpdykgtwi hpeidnpeys 301 pdaniyayds favlgldlwq vksgtifdnf litndeayae efgnetwgvt 351 kaaekqmkdk qdeeqrlkee eedkkrkeee eaedkededd rdededeede 401 keedeedatg qakdel Рисунок 13. Аминокислотная последовательность типичного кальретикулина (21-332 – кальретикулин, 1-17 – сигнальная последовательность, удаляемая протеолизом при созревании белка). Участки последовательности, общие с белком с м.м. 55 кДа, выделены серым цветом Классический кальретикулин входит в состав семейства высококонсервативных белков с м.м. около 55 кДа, локализующихся как в саркоплазматическом, так и в эндоплазматическом ретикулуме клеток печени, скелетной и гладкой мускулатуры, сердечной мышцы [Fliegel et al., 1989]. Белки этого семейства связывают ионы кальция, цинка, других металлов, сахара, нуклеотидфосфаты, в частности, УДФ. Они также выступают в роли шаперонных белков в процессе фолдинга, участвуют в системе белковой машинерии, регуляции апоптоза, мейоза, экспорта белков из ядра клетки. Известны гомологи гена кальретикулина у мыши, крысы и человека. У крысы гомологичный ген кальретикулина локализован в 19 хромосоме. При этом ранее в нашей лаборатории было показано, что при окрашивании белков в геле после ДДС-ПААГ электрофореза по Шиффу, исследуемый белок с м.м. 55 кДа давал положительную реакцию, что говорит о способности его связывать сахара [неопубликованные данные]. Кроме того, определялось также и сродство белка-канала к кальцию с использованием 45Ca [неопубликованые данные]. Было показано, что исследуемый белок с м.м. 55 кДа проявляет достаточно большое сродство к этому иону. Эти результаты согласуются с данными по взаимодействию кальретикулина с сахарами и кальцием. Причем, необходимо заметить, что большая часть перекрывающейся последовательности приходится на Р-домен кальрегулина, способного связывать нуклеотиды. Также, в перекрывающуюся последовательность включены высоконсервативные остатки триптофана, характерные для кальрегулинов в данных сайтах первичной последовательности, и стерически идентично расположенные в первичной аминокислотной последовательности кальрегулина консервативные антипараллельные бета-листы, формирующие Р-домен. Следует особенно отметить тот факт, что в составе прекурсорного белка и кальретикулинов различных типов имеется характерная гидрофобная сигнальная последовательность из 17 аминокислотных остатков, MLLSVPLLLGLLGLAAA (1-17), посттрансляционно удаляемая протеолитическим расщеплением [Murthy et al., 1990] (Рис.16). Эта последовательность отсутствует в изучаемом нами белке с м.м. 55 кДа. Интересно также то, что N-концевая последовательность с 17 по 27 аминокислотный остаток DPAIYFKE кальретикулина совпадает с последовательностью N-концевого участка 55 кДа белка, структура которого была определена ранее в нашей лаборатории реакцией химической деградации по Эдману [неопубликованные данные] (Рис.16). Кроме того, С-конец прекурсорного белка, как и всех кальретикулинов, содержит сигнальную последовательность KDEL, определяющую локализацию этих белков в ретикулюме [Schweizer et al., 1993], в то время как у изучаемого 55 кДа белка такой последовательности нет (Рис.15, 16), что, вероятно, свидетельствует о том, что белок с м.м. 55 кДа локализуется не в ретикулюме. 1 MLLSVPLLLG LLGLAAADPA IYFKEQFLDG DAWTNRWVES KHKSDFGKFV 51 LSSGKFYGDQ EKDKGLQTSQ DARFYALSAR FEPFSNKGQT LVVQFTVKHE 101 QNIDCGGGYV KLFPGGLDQK DMHGDSEYNI MFGPDICGPG TKKVHVIFNY 151 KGKNVLINKD IRCKDDEFTH LYTLIVRPDN TYEVKIDNSQ VESGSLEDDW 201 DFLPPKKIKD PDAAKPEDWD ERAKIDDPTD SKPEDWDKPE HIPDPDAKKP 251 EDWDEEMDGE WEPPVIQNPE YKGEWKPRQI DNPDYKGTWI HPEIDNPEYS 301 PDANIYAYDS FAVLGLDLWQ VKSGTIFDNF LITNDEAYAE EFGNETWGVT 351 KAAEKQMKDK QDEEQRLKEE EEDKKRKEEE EAEDKEDEDD RDEDEDEEDE 401 KEEDEEDATG QAKDEL Рисунок 14. Последовательность прекурсорного белка. Сигнальная последовательность, характерная для кальретикулинов, выделена серым цветом, N-концевая последовательность, гомологичная таковой у исследуемого белка-канала с м.м. 55 кДа – жирным шрифтом, сигнальная последовательность KDEL, остутствующая в изучаемом белке – серым цветом и жирным шрифтом Следует также отметить, что кальретикулины содержат ряд высоко консервативных последовательностей [Fliegel et al., 1989]. Согласно результатам MS-MALDI-TOF/TOF анализа, ряд гомологичных с белком предшественником участков цепи белка с м.м. 55 кДа являются высококонсервативными для белков семейства кальретикулинов. Возможно, исследуемый нами белок, гомологичный кальрегулину, проходит альтернативные стадии пострансляционных модификаций и созревания при биосинтезе. Это, вероятно, позволяет ему встраиваться во внутреннюю мембрану митохондрий беспрепятственно и без значительных потерь энтропии и внутренней энергии при смене гидрофильной среды на гидрофобную. Не исключено также дополнительное стерическое и физико-химическое влияние на химические свойства и конформационную норму со стороны компонентов мембраны митохондрий. Учитывая все вышесказанное, на данном этапе исследования структуры митоКАТФ, можно утверждать лишь, что белок с м.м. 55 кДа является белком, обладающим высокой степенью структурной и функциональной гомологии с кальрегулином. Учитывая все вышесказанное, на данном этапе исследования структуры митоКАТФ, можно утверждать лишь, что белок с м.м. 55 кДа является белком, обладающим высокой степенью структурной и функциональной гомологии с кальрегулином. 5.3 Ингибиторный анализ активности митоКАТФ канала с использованием антител, полученных на белок с м.м. 55 кДаВ нашей лаборатории были получены косвенные доказательства гетеромультимерного строения этого канала, а также данные о том, что белок с м.м. 55 кДа является канальной субъединицей митоКАТФ [Григорьев, 1999; Негода, 2004; Mironova et al., 2004]. В то же время, результаты исследования гомологичности структуры белка-канала с м.м. 55 кДа, выделенного из МХ печени крысы, показали высокий процент гомологии исследуемого белка с кальрегулином. Таким образом, возникла необходимость доказательства принадлежности белка с м.м. 55 кДа к системе митохондриального АТФ-зависимого транспорта калия. Для прямого доказательства принадлежности каналообразующего белка с м.м 55 кДа к митохондриальной системе АТФ-ингибируемого транспорта К+, в работе на этот белок были получены поликлональные антитела (АТ) и проведен анализ их влияния на АТФ-зависимый транспорт калия в интактных МХ. Предварительные данные по влиянию АТ к 55 кДа белку на транспорт К+ в МХ были получены в лаборатории ранее [Скарга и др., 1986]. Однако в о время, белок не был идентифицирован как АТФ-зависимый К+ канал и методы его очистки были несовершенны. Кроме того, не все использовавшиеся ранее модели отражали работу АТФ-зависимого митоходнриального калиевого кнала. Не было также проведено сравненительное исследование по влиянию АТ к 55 кДа белку на другие функции МХ. 5.3.1 Определение степени чистоты белка, используемого для иммунизацииДля получения поликлональных специфических антител на белок-канал необходимо было получить гомогенный белок с м.м. 55 кДа. Этот белок выделяли из МХ печени крысы методом водно-этанольной экстракции [Миронова и др., 1981; 1996(I)]. Дальнейшую очистку белка проводили методом ионообменной хроматографии с использованием ДЭАЭ-целлюлозы (п.п. 2 «Материалов и методов»). Каналообразующий белок элюировался с колонки 250 мМ KCl. Чистота данной фракции определялась ДДС-ПААГ электрофорезом [Laemmli, 1979] (Рис.5). Для обнаружения активной фракции, все фракции, элюированные с колонки ДЭАЭ-целлюлозы тестировали при встраивании в БЛМ (см. «Материалы и методы»). Далее активную фракцию (250 мМ KCl) диализовали против 5 мМ Трис буфера (pH 7.2) с добавлением 0.1% b-меркаптоэтанола в течение ночи при 4°С. Диализат повторно наносили на колонку ДЭАЭ-целлюлозы, аналогичную использовавшейся в первом случае. Фракции элюировали ступенчатым градиентом KCl. Все фракции тестировались на активность при встраивании в БЛМ. АТФ-ингибируемые К+-селективные каналы формировались, как правило, при встраивании белка, элюированного 250 мМ KCl. Дополнительная очистка проводилась методом препаративного нативного электрофореза (п.п. 5.1.1. «Материалов и методов») в 10%-ом ПААГ. На конечной стадии очистки, исследуемый белок элюировали из геля, концентрировали методом обратного диализа на ПЭГ и проверяли на ДДС-ПААГ электрофорезе (Рис.17). Электрофоретическая подвижность белка соответствовала массе ~55 кДа.

Рис. 15. Результат ДДС-ПААГ электрофореза фракции, полученной после нативного электрофореза и содержащей белок с м.м. 55 кДа. 1 – стандарт молекулярных масс, 2 – фракция митоКАТФ канала после нативного электрофореза Полученным электрофоретически гомогенным белком с м.м. 55 кДа модифицировали искусственные бислойные мембраны. Было показано, что данный белок обладает селективной К+-транспортирующей активностью и ингибируется физиологическими концентрациями АТФ (Рис.18).
Рисунок 16. К+-транспортирующая АТФ-ингибируемая активность белка с м.м. 55 кДа, реконструированного в искусственную мембрану. Среда инкубации содержала: 20 мМ Трис, 100 мМ KCl, рН 7.2 Электрофоретически гомогенный АТФ-ингибируемый К+-транспортирующий белок с м.м. 55 кДа и замораживали и накапливали для иммунизации. При выделении вышеописанным методом из 100 г печени крыс получали 30-70 мкг очищенного белка. Иммунизацию кроликов проводили при накоплении 0.2-0.4 мг белка. 5.4 Иммунизация и определение титра полученных антителПеред началом иммунизации отбирали 30-40 мл крови каждого животного для приготовления нормальной контрольной сыворотки. Для получения антител к АТФ-ингибируемому К+-транспортирующему белку с м.м. 55 кДа кроликов иммунизировали электрофоретически чистым белком. С целью устранения индивидуальных различий в получаемых анителах иммунизировали двух кроликов массой 2.6-2.8 кг. Схема эксперимента была подобрана в соответствии с требованиями Декларации совета Европейского Союза 86/609/EEC и представлена в таблице 8. Инъекции делали подкожно в область лопаток в 3 подхода. Интервал между инъекциями 10-15 дней. В ходе иммунизации кроликов по представленной выше схеме были получены антитела к белку с м.м. 55 кДа, выделенному из МХ печени крысы. Определение титра антител, полученных на белок-канал с м.м. 55 кДа проводили методом непрямого дот-анализа (см. «Материалы и методы»). Средние значения титра антител указаны в таблице 8. Таблица 2. Схема иммунизации кроликов АТФ-зависимым К+-транспортирующим белком м.м. 55 кДа.
5.4.1 Определение специфичности полученных антителСпецифичность антител на белок с м.м. 55 кДа определяли методом Вестерн-блот. Для этого выделенный из МХ печени крысы и очищенный АТФ-чувствительный К+-транспортирующий белок с м.м. 55 кДа наносили на ДДС-ПААГ электрофорез с 10%-ым ПААГ гелем с нагрузкой на полосу 10 мкг. На другую полосу наносили 10 мкг тотальной белковой фракции МХ. Порядок нанесения образцов дублировался на том же геле. После электрофоретического разделения белков половина геля, содержащая оба образца и стандарт молекулярных масс, окрашивалась серебрением [Shevchenko et al., 1996]. Вторая половина использовалась для переноса на нитроцеллюлозную мембрану с последующей обработкой полученными антителами (п.п. 5.2.2. «Материалов и методов»). При этом исследуемую антисыворотку разводили 1:300, вторичные антитела – 1:500. |
||||||||||||||||||||||||||||||||||||||||||||||||
Copyright © 2012 г.
При использовании материалов - ссылка на сайт обязательна.
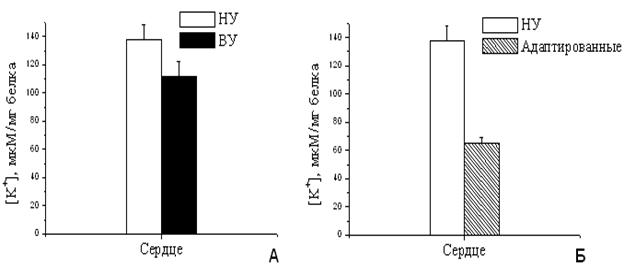 Рисунок 11. Количество К+
в МХ сердца крыс с различной резистентностью (А) и адаптированных к
гипоксии (Б)
Рисунок 11. Количество К+
в МХ сердца крыс с различной резистентностью (А) и адаптированных к
гипоксии (Б)