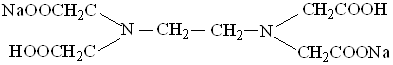|
|
МЕНЮ
|
Учебное пособие: Аналитическая химия1000 1000
Лабораторная работа №10 "Потенциометрическое определение хлорид-, бромид- и йодид-ионов при совместном присутствии" Потенциометрическое титрование, основанное на реакциях осаждения, применяется для определения серебра, а так же хлоридов, бромидов, йодидов, роданидов и сульфидов. В качестве титрующего раствора применяется рабочий раствор АgNО3. Электродом определения служит серебряный электрод − металлический индикаторный электрод I-го рода. Электродом сравнения служит хлорсеребряный электрод − металлический индикаторный электрод II-го рода. Потенциометрический метод позволяет определить концентрации нескольких ионов при их совместном присутствии при условии, что отношение растворимостей образующихся при титровании серебряных солей должно быть не менее 40. При добавлении раствора АgNО3 к исследуемому раствору, содержащему смесь хлорид-, бромид- и йодид-ионов, образуются осадки малорастворимых солей серебра. Значения произведения растворимости галогенидов серебра различно. ПРАgI = 10−16; ПРАgВr = 10−13; ПРАgСl = 10−10. При титровании вначале образуется осадок, у которого ПР имеет наименьшее значение (АgI), затем выпадает осадок АgВr, и последним осаждается АgСl. Осаждение АgI будет происходить до тех пор, пока произведение концентраций Аg+ и Вr− будет меньше значения их произведения растворимости: С(Аg+) · С(Вr−) < ПРАgВr, где С(Вr−) − концентрация ионов брома в исследуемом растворе. Осадок бромида серебра начнет образовываться, когда концентрация ионов серебра в растворе настолько возрастет, что С(Аg+) С(Вr−) = ПРАgВr. Концентрация ионов йода в точке эквивалентности зависит от концентрации ионов брома в исходном растворе. Чем выше концентрация ионов, тем больше будет ошибка при титровании. Если концентрации ионов брома и йода одинаковы, то ошибка титрования минимальна. Аналогично в точке эквивалентности при осаждении бромида серебра ошибка титрования будет зависеть от концентрации ионов хлора в исходном растворе. Ошибка при титровании в точке эквивалентности будет мала, если концентрация ионов хлора в исследуемом растворе будет в 5 раз меньше концентрации ионов брома. Методика анализа В мерную колбу получают раствор задачи, в которую предварительно для уменьшения адсорбции ионов галогенидов на поверхности осадка было введено 25 мл 7 % раствора нитрата бария. Объем в колбе дистиллированной водой доводят до метки и тщательно перемешивают. В стаканчик для титрования пипеткой вносят две аликвотные части раствора задачи, объем в стаканчике доводят до 50 мл дистиллированной водой и опускают туда серебряный электрод. При помощи солевых мостиков, содержащих насыщенные растворы КСl и КNО3 соединяют реакционный сосуд с хлорсеребряным электродом. Схема гальванического элемента: (−) Аg │АgI, I−, Вr−, Сl− ║ КNО3 ║ КСl ║ КСl, АgСl│ Аg (+) серебр.эл-д исслед.р-р хлорсеребр.эл-д Включают магнитную мешалку, отрегулировав скорость вращения, и измеряют ЭДС гальванического элемента с помощью иономера. ЭДС цепи определяется: Е = φ°АgНаl − φ°хлорсер. − 0,058 lg СНаl- Теоретические основы потенциометрического титрования рас-сматриваются в разделе 6. Титрование осуществляют рабочим раствором АgNО3 с установленным титром, прибавляя его по 0,2 мл. Результаты измерения вносят в таблицу (см. раздел 6) и по полученным данным на миллиметровой бумаге строят интегральную зависимость Е = f(Vраб.р-ра). По кривой определяют примерное положение точек эквивалентности. Для нахождения эквивалентных объемов строят дифференциальную кривую в координатах ∆Е/∆V от V'. Интегральная и дифференциальная кривые должны быть построены в одном масштабе. Дифференциальная кривая будет иметь три максимума. Проведя перпендикуляр от этих максимумов на ось абсцисс, находят значения трех эквивалентных объемов V1', V2' и V3' с точностью до 0,02 мл. Результаты анализа выражают в граммах галогенид-ионов в задаче: V1’ N(АgNО3) · Мэ(I) · Vк m(I−) = --------------------------------- 1000 2Vп ( V2' − V1') N(АgNО3) · Мэ(Вr) · Vк m(Вr−) = -------------------------------------------- 1000 2Vп ( V3' − V2') · N(АgNО3) · Мэ(Сl) · Vк m(Сl−) = -------------------------------------------- , где 1000 2Vп V1', V2', V3' − эквивалентные объемы, мл; Vк − объем колбы, мл; Vп − объем пипетки, мл. 5. МЕТОД КОМПЛЕКСОНОМЕТРИЧЕСКОГО ТИТРОВАНИЯ Комплексонометрия − раздел титриметрического анализа, основанный на реакциях комплексообразования между определяемым ионом металла (М) и титрантом (комплексоном). Катионы металла (М), содержащие вакантные d-орбитали, реагируют с донорами электронной пары − лигандами (L), образуя координационные соединения − хелаты. Хелатообразующий лиганд с двумя донорными группами, участвующими в образовании координационной связи, называется бидентатным; лиганд с тремя донорными группами − тридентатным и т.д. Хелатообразование всегда протекает в одну стадию, тогда как при образовании комплекса образуется несколько промежуточных соединений. В аналитических целях реакцию комплексообразования можно использовать, только если образуется комплекс типа МL состава 1:1, в котором к каждому металла присоединен один лиганд, поскольку для таких систем характерно наибольшее изменение значения рМ вблизи точки эквивалентности. Наиболее широкое применение в комлексонометрии нашли комплексоны. Это полиаминокарбоновые кислоты, образующие с ионами металлов комплексные соединения: этилендиаминтетрауксусная кислота (ЭДТУ) − комплексон II и ее двунатриевая соль (ЭДТА), которую называют комплексон III или трилон Б:
Препарат в виде белого растворимого в воде порошка является кристаллогидратом состава Nа2Н2Т · 2Н2О, где Т − анион ЭДТУ. ЭДТУ − слабая четырехосновная кислота (Н4Т), характеризующаяся четырьмя ступенями диссоциации: рКI = 2,0; рКII = 2,67; рКIII = 6,16; рКIV = 10,26. Близкие значения рКI и рКII показывают, что отщепление первых двух протонов протекает легче, чем отщепление двух оставшихся. Данная соль относительно хорошо растворима в воде и диссоциирует, как сильный электролит: Nа2Н2Т → 2Nа+ + Н2Т2− Трилон Б взаимодействует со всеми катионами металлов II−IV аналитических групп. Реакции взаимодействия трилона Б с катионами металлов выражают уравнениями: М2+ + Н2Т2−
М3+ + Н2Т2−
М4+ + Н2Т2−
Таким образом, ЭДТА реагирует с ионами металлов с образованием комплекса 1:1, независимо от заряда катиона. В результате реакции взаимодействия происходит замещение двух катионов водорода, поэтому fэкв(М) = ½. Указанные равновесия зависят от рН раствора. Для обеспечения полноты протекания реакции значение рН поддерживают постоянным, применяя для этого соответствующий буферный раствор. Чем выше заряд иона металла, тем прочнее образующийся комплексонат и тем более кислая среда допускается в ходе титрования. Водные растворы комплексона III и большинства комплексонатов металлов бесцветны. Конец титрования обычно определяют с помощью металлиндикаторов. Это органические вещества, образующие цветные комплексные соединения с определяемым катионом. Свободный индикатор и его комплекс с ионом металла окрашены неодинаково. Устойчивость комплекса индикатора с металлом должна быть высокой, но ниже устойчивости комплекса металла с комплексоном. Раствор трилона Б готовят из высушенной при 80°С навески. Для определения точной концентрации раствора трилон Б используют стандартный раствор МgSО4, приготовленный из стандарт-титра или навеску металлического цинка, растворенную в соляной или серной кислоте. 5.1. Стандартизация раствора трилон Б Для определения точной концентрации раствора трилон Б применяется стандартный раствор сульфата магния, приготовленный из стандарт-титра. Концентрация раствора МgSО4 = 0,01 моль/л. В качестве индикатора используется кислотный хромовый темно-синий. В основе определения лежат реакции: 1) образование комплекса катиона магния с индикатором: рН ~ 9 Мg2+ + Нind2−
синий винно-красн. 2) образование более прочного комплекса катиона магния с рабочим раствором трилон Б с выделением свободной формы индикатора: рН ~ 9 МgInd22−
+ Nа2Н2Т винно-красн. раб.р-р бесцв. синий Методика анализа В колбу для титрования последовательно из бюретки отмеряется 4,0; 5,0 и 6,0 мл стандартного 0,01 М раствора МgSО4, цилиндром отмеряется 5 мл аммиачного буферного раствора, добавляется 1 капля индикатора. Объем в колбе примерно вдвое разбавляется дистиллированной водой, смывая капли растворов со стенок внутрь колбы. Полученный раствор титруют трилоном Б до перехода винно-красной окраски раствора в синюю. Расчет концентрации раствора трилона Б производится на основе закона эквивалентов:
N(МgSО4) V(МgSО4) N(Nа2Н2Т) = --------- V(Nа2Н2Т) По трем значениям концентрации раствора трилон Б рассчитывается среднее значение концентрации этого раствора.
Лабораторная работа №11 "Определение содержания Аl3+ методом обратного титрования" Метод определения основан на том, что в кислой среде катионы алюминия образуют с трилоном Б прочное комплексное соединение (lg β = 16,13). Для разрушения гидратной оболочки комплекса и увеличения скорости реакции образования комплексоната алюминия проводят кипячение раствора соли алюминия с трилоном Б, взятом в избытке. По окончании реакции избыток трилона Б оттитровывается стандарным раствором сульфата цинка. В качестве индикатора используется ксиленоловый оранжевый, который в слабокислом растворе (рН ~ 5) в присутствии уротропина (гексаметилтетраамина) имеет лимонно-желтую окраску. От избыточной капли раствора сульфата цинка окраска индикатора меняется на красно-розовую за счет образования комплекса цинка с индикатором. В основе определения лежат следующие реакции: рН ~ 5 Аl3+ + Н2Т2−
отмерен.изб. остаток Н2Т2−
+ ZnSО4
остаток 2-ой раб.р-р ZnSО4 + Нind2−
изб.капля желт. красн.-роз. По уравнению реакции и с учетом закона эквивалентов содержание алюминия определяется: q(Аl3+) = q(Nа2Н2Т) − q(ZnSО4).
Методика анализа В мерную колбу получают раствор задачи, доводят до метки дистиллированной водой и тщательно перемешивают. В колбу для титрования пипеткой переносят аликвотную часть задачи, добавляют из бюретки 10 мл рабочего раствора трилон Б и 3 мл 2 н раствора НNО3. Колбу накрывают стеклянной воронкой и раствор кипятят в течении 5 мин. Затем воронку над колбой ополаскивают дистиллированной водой, чтобы исключить потери раствора, и раствор охлаждают до комнатной температуры. В колбу для титрования добавляют 2 г предварительно взвешенного на технических весах уротропина. Содержимое колбы перемешивают круговыми движениями до растворения уротропина и добавляют на кончике шпателя ксиленоловый оранжевый. Смесь титруют вторым рабочим раствором ZnSО4 до перехода окраски индикатора из желтой в красно-розовую. Расчет содержания алюминия (III) в задаче проводят по среднему результату, полученному из данных титрования трех параллельных опытов: N(Nа2Н2Т) · V(Nа2Н2Т) N(ZnSО4) · V(ZnSО4) m(Аl3+) = 10 ·│----------------------------- − --------│· Мэ(Аl) 1000 1000
Лабораторная работа №12 "Определение общей жесткости воды" Наличие Са2+ и Мg2+ в природных водах определяет их жесткость. Различают карбонатную (временную) и некарбонатную (постоянную). Первая обусловлена присутствием бикарбонатов (Са(НСО3)2 и Мg(НСО3)2), вторая − сульфатами (СаSО4 и МgSО4) или их хлоридами (СаСl2 и МgСl2). Карбонатную жесткость устраняют кипячением или прибавлением к воде гидроксида кальция: Са(НСО3)2 + Са(ОН)2 → 2СаСО3↓ + 2Н2О Постоянную жесткость устраняют прибавлением к воде соды: СаSО4 + Nа2СО3 → СаСО3↓ + Nа2SО4 Сумма временной и постоянной жесткости воды составляет общую жесткость, выраженную мг-экв ионов Са2+ и Мg2+ на 1л воды. В основе определения лежат реакции: Мg2+ + Нind2−
синий винно-красн. Са2+ + Нind2−
синий винно-красн. рН ~ 9 (Са)МgInd22−
+ Nа2Н2Т винно-красн. раб.р-р бесцв. синий Методика анализа Пробу воды в мерной колбе доводят до метки дистиллированной водой и тщательно перемешивают. В колбу для титрования пипеткой отмеряют аликвотную часть исследуемого раствора, добавляют 5 мл аммиачного буферного раствора, разбавляют дистиллированной водой, смывая капли растворов со стенок внутрь колбы, и 1 каплю хром темно-синего. Смесь титруют стандартным раствором трилона Б до перехода окраски индикатора из винно-красной в синюю. Определение повторяют трижды и вычисляют значение среднего объема трилона Б Vср(Nа2Н2Т), мл. Результаты определения выражают суммарным количеством миллиграмм-эквивалентов (q) ионов кальция и магния в одном литре исследуемой пробы: Vср(Nа2Н2Т) · N(Nа2Н2Т) · 1000 q = ----------------------------------------- , Vп где Vп − объем пипетки, мл. 6. ПОТЕНЦИОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
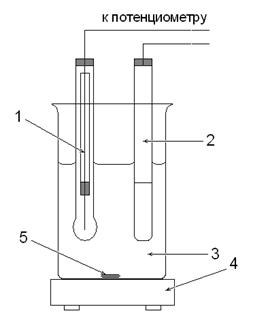
Рис. 1. Ячейка для определения рН раствора
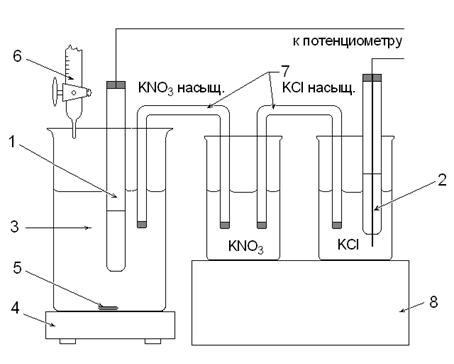
1. Индикаторный серебряный электрод. 2. Насыщенный хлорсеребряный электрод. 3. Исследуемый раствор. 4. Магнитная мешалка. 5. Магнитный стержень. 6. Бюретка с рабочим раствором AgNO3. 7. Мостики. 8. Штатив. Рис. 2. Ячейка для определения галогенид-ионов. Установка для потенциометрического титрования состоит из внешнего источника тока, чувствительного гальванометра (или постоянного усилителя), электролитической ячейки и регистрирующего прибора со шкалой в единицах рН или вольтах (см. рис. 1 и 2). 6.4. Правила работы на рН-метре-милливольтметре В потенциометрическом титровании вместо потенциометров можно использовать рН-метры. рН-метр-милливольтметр типа рН-673М позволяет проводить анализ методом прямого потенциометрического титрования. Шкала прибора отградуирована в единицах рН или мВ и позволяет работать в диапазоне рН −1 ÷ 14 и в диапазоне потенциалов −1400 ÷ 1400 мВ. Прибор готов к работе через 30 мин после включения в сеть. Приступая к работе, необходимо тщательно промыть электроды дистиллированной водой, убедиться в правильности сборки электрохими-ческой цепи, а также в том, что электроды надежно закреплены и погружены в растворы, отрегулировать скорость вращения мешалки, чтобы исключить разбрызгивание раствора. При малом объеме анализируемого раствора в стакан добавляют дистиллированную воду для того, чтобы концы электродов были погружены в раствор. При отсчете показаний значений рН ориентировочные измерения проводят по нижней шкале прибора в диапазоне −1÷14. На основании полученного предварительного значения рН точные измерения необходимо проводить в одном из узких диапазонов (−1÷4; 4÷9 или 9÷14), при этом отсчет проводят по верхней шкале. При измерении потенциалов (+mV или −mV) также сначала ориентировочно оценивают величину потенциала по нижней шкале прибора, а при точном определении показаний по верхней выбранной шкале в соответствующем узком диапазоне, полученные значения умножают на 100. 6.5. Обработка результатов потенциометрического титрования При проведении потенциометрического титрования по бюретке отмечают объем добавленного рабочего раствора (V, мл), а по шкале потенциометра (рН-метра-милливольтметра) полученные значения рН или потенциал (Е, мВ). Результаты титрования заносят в таблицу1 или 2. Табл. 1
Табл. 2
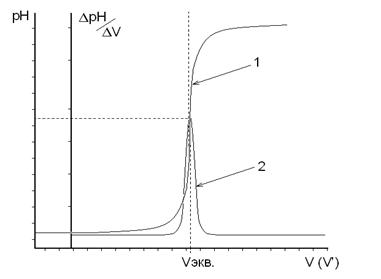
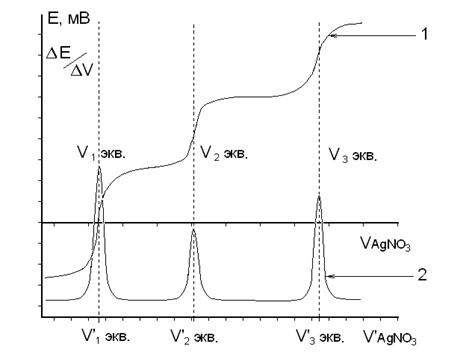
В графу 2 таблицы записывают объем добавленного рабочего раствора (V, мл), в графу 3 − установившееся при этом значение рН или Е (мВ). В графы 4-7 записывают результаты обработки первичных экспериментальных данных. В графу 4 − разность объемов титранта между двумя последующими значениями 2-ой графы (шаг титрования); в графу 5 − разность показаний прибора между двумя последующими значениями графы 3; графа 6 − результат деления значения графы 5 на значение графы 4; в графу 7 (V', мл) помещают значения, рассчитанные как среднее арифметическое двух последующих значений графы 2. Титрование считают законченным, когда после достижения максимальных значений ΔрН или ΔЕ прибавлено еще не менее трех порций рабочего раствора. По данным титрования строят на миллиметровой бумаге две кривые: в координатах "рН − V" или "Е − V" − интегральную кривую; в координатах " ΔрН/ΔV − V' " или " ΔЕ/ΔV − V' " − дифференциальную кривую. По дифференциальной кривой находят значение эквивалентного объема рабочего раствора (Vэкв, мл), которое используют для расчетов результатов анализа (рис.3). Если в процессе титрования происходит последовательное титрование нескольких ионов (например, галогенидов раствором АgNО3), то на дифференциальной кривой будут наблюдаться несколько максимумов, каждому из которых будет соответствовать свой эквивалентный объем (рис.4). В этом случае предполагается, что титрование каждого последующего иона происходит лишь после полного осаждения предыдущего иона.
Рис. 3. Графики зависимости рН от объема добавленного титранта. 1 – Интегральная кривая 2 – Дифференциальная кривая
Рис. 4. Графики зависимости электродного потенциала от объема добавленного титранта. 1 – Интегральная кривая 2 – Дифференциальная кривая ЛИТЕРАТУРА 1. Васильев В.П., Морозова Р.П., Кочергина Л.А. Практикум по аналитической химии. − М.: «Химия», 2000. − 327 с. 2. Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. Т.I. − М.: «Химия», 1990. − 479 с. 3. Васильев В.П. Аналитическая химия. Т.I. − М.: «Высшая школа», 1989. − 319 с. 4. Алексеев В.Н. Количественный анализ. − М.: «Химия», 1972. −504 с. 5. Крешков А.П. Основы аналитической химии. Т.2. − М.: «Химия», 1976. − 480 с. |