Глава
84 Нестероидные противовоспалительные средства (НПВС)
David H Collier, MD
Глава
85 Глюкокортикоиды — системные и вводимые местно
GregoryJ Dennis,MD
Глава
86 Системные антиревматические препараты
James О 'Dell, MD
Глава
87 Цитостатики и иммуномодуляторы
James О 'Dell, MD
Глава
88 Гипоурикемические средства и колхицин
DavidR Finger,MD
Глава
89. Препараты, укрепляющие кости
Michael T. McDermott,
M.D.
Глава
90. Методики реабилитации
Douglas E. Hemler, M.D.
Глава
91. Психосоциальные аспекты ревматических заболеваний
Elizabeth Kozora, Ph.D.
Глава
92. Хирургическое лечение ревматических заболеваний
John A. Reister, M.D.
Глава
93. Нетрудоспособность
Scott Vogelgesang, M.D.
XV. Лечение ревматических
заболеваний
При лечении болезней имейте привычку
соблюдать два правила:помогать или, по крайней мере, не вредить.
Гиппократ (460-377 до н. э.)
ГЛАВА 84. НЕСТЕРОИДНЫЕ
ПРОТИВОВОСПАЛИТЕЛЬНЫЕ СРЕДСТВА (НПВС)
David H. Collier, M.D.
1. Опишите общие свойства
НПВС.
НПВС — это слабые органические
кислоты, быстро связывающиеся с белками плазмы (в основном с альбуминами).
Большинство из них имеют константу ионизации (рКо) от 3 до 5. Поэтому
в кислой среде желудка НПВС находятся в неионизированном состоянии, что
может приводить к локальному повреждению его слизистой оболочки. Выгодным
свойством НПВС является то, что они накапливаются преимущественно в воспаленных
тканях, поэтому период полувыведения этих препаратов из синовиальной жидкости
больше, чем из плазмы. НПВС имеют противовоспалительные свойства, обусловленные
в основном ингибированием продукции простагланди-нов, а также рядом других
механизмов.
2. Когда впервые начали
применять НПВС?
Салицилаты, вероятно, использовались
в течение многих веков. Еще Гиппократ, Цельс, Гален и многие другие средневековые
знатоки трав оставили свидетельства использования коры ивы и других растений,
содержащих салицилаты, для лечения лихорадки и уменьшения боли. Несколько
дат из более современной истории медицины:
1826 г. — из коры ивы выделен
салицилин, активная основа салицилатов;
1838 г. — из салицилина получена
салициловая кислота;
1853 г. — синтезирован ацетилсалицилат
(аспирин);
1899 г. — аспирин стал применяться
в США;
1949 г. — стал использоваться
фенилбутазон, первая альтернатива салицилатам;
1965 г. — в клиническую практику
введен индометацин.
Хотя аспирин впервые был
синтезирован еще в 1853 г., его не использовали до конца XIX века, когда
Ф. Хофман (F. Hoffman) из компании Байер (Вауег) попробовал применить его
для лечения своего отца, страдавшего артритом, и это явилось сразу же 1-й,
2-й и 3-й стадиями тестирования препарата. Для новых лекарственных средств,
вводимых в клиническую практику сегодня, затраты составляют многие миллионы
долларов за средний период внедрения, равный 10 годам. С 1960-х гг. началось
широкое распространение НПВС. В некоторых странах их перечень включает
сейчас до 40 наименований.
3. Как часто используют НПВС?
Подсчитано, что в США в 1993
г. более чем 100 млн пациентам были прописаны НПВС (не салицилаты) общей
стоимостью более 1 млрд долл.
4. Каковы полезные эффекты
НПВС?
Аналгетический — при острых
болях сравним с таковым у наркотиков (в терапевтических дозах)
Жаропонижающий — НПВС ингибируют
простагландины в ЦНС, снижая тем самым лихорадку
Противовоспалительный — осуществляется
посредством нескольких механизмов
Антитромботический — уменьшают
агрегацию тромбоцитов путем ингибирова-ния продукции тромбоксана А2,
важного фактора активации тромбоцитов, тормозя, таким образом, первую ступень
процесса коагуляции
5. Какова структурная классификация
НПВС? Салицилаты
Ацетилированные — аспирин
Неацетилированные — натрия
салицилат, холина салицилат, магния салици-
лат, салсалат, салициламид,
дифлунизал Ацетокислоты
Производные индола — индометацин,
толметин, сулиндак
Фенилацетовая кислота — диклофенак
Пиранокарбоксиловая кислота
— этодалак Пропионовые кислоты — ибупрофен, напроксен, фенопрофен, кетопрофен,
флурбипрофен, оксапрозин
Фенамовые кислоты — мефенамовая
кислота, меклофенамовая кислота Эноловые кислоты
Оксикамы — пироксикам
Пиразолоны — фенилбутазон
Некислотные структуры
Нафтилалканон — набуметон
6. Почему необходимо знать
структурную классификацию НПВС?
Препараты каждого класса
обычно имеют сходные побочные эффекты. Например, пиразолоны, которые в
США были некоторое время представлены двумя препаратами — оксифенбутазоном
и фенилбутазоном. Из-за случаев развития идиосинкразической апластической
анемии оксифенбутазон был изъят из продажи, а ведущие фармацевтические
фирмы прекратили производство фенилбутазона. Частым побочным эффектом салицилатов
является шум в ушах. Производные пропионовой кислоты в целом — относительно
безопасная группа, и три препарата из этой группы в настоящее время имеются
в продаже — ибупрофен, напроксен-натрий и кетопрофен. Второй, хотя и спорной,
причиной необходимости знать структурную классификацию НПВС является выбор
альтернативного лечения. Если препарат одного класса не эффективен, вы
можете попытаться применить средство с другой структурой вместо использования
препаратов одной и той же группы.
7. Расскажите о механизме
действия НПВС.
Основным механизмом действия
считается ингибирование циклооксигеназы, ведущее к снижению продукции простагландинов.
Другие механизмы, выявленные для различных НПВС, включают:
• ингибирующее действие на
продукты липоксигеназы (сулиндак, меклофена-мат, диклофенак);
• ингибирование образования
супероксидов (индометацин, пироксикам);
• ингибирование агрегации
и адгезии нейтрофилов, процесса выброса ими ферментов (салицилаты, индометацин);
• депрессия трансформации
лимфоцитов (салицилаты);
• ингибирование продукции
ревматоидного фактора (пироксикам);
• ингибирование продукции
цитокинов;
• супрессия продукции протеогликанов
в хрящах (салицилаты, пироксикам, ибупрофен, фенопрофен, толметин).
8. Какие факторы влияют на
выбор НПВС? Свойства препарата Пациент
Эффективность Индивидуальная
чувствительность
Устойчивость Заболевание
Безопасность Возраст
Удобство дозирования Сопутствующая
патология
Форма препарата Прием других
препаратов
Стоимость
9. Как исследуется эффективность
НПВС?
Эффективность большинства
НПВС сравнивалась с аспирином и, в более поздних исследованиях,— с напроксеном.
В целом не выявлено существенной разницы между НПВС, хотя имеются отчетливые
индивидуальные вариации ответа. При определенных артритических заболеваниях
препараты одной из структурных групп могут быть средствами первого выбора.
Например, при подагре и серонегативных спондилоарт-ропатиях предпочтительно
сначала назначать индометацин или толметин. При артрите отсутствует четкая
взаимосвязь между степенью подавления циклооксигеназы и активностью препарата.
Хотя фармакодинамика препарата важна для конкретного пациента, нет достоверной
корреляции между концентрацией в плазме и эффективностью НПВС, за исключением
салицилатов.
10. У кого велик риск возникновения
реакций гиперчувствительности к НПВС?
Самый высокий риск у пациентов
с тяжелой бронхиальной астмой и полипами носа — до 78 % таких пациентов
дают побочные реакции на аспирин. Пациенты с носовыми полипами, астмой
или хронической крапивницей также имеют повышенный риск гиперреакции на
НПВС, обычно в виде бронхоспазма и одышки. Важно отметить, что это именно
реакции гиперчувствительности, а не аллергия, поскольку они не опосредованы
IgE.
11. Расскажите о гепатотоксичности
НПВС.
Клиренс НПВС осуществляется
преимущественно путем печеночного метаболизма с образованием неактивных
метаболитов, экскретируемых с мочой. Некоторый подъем печеночных ферментов,
особенно аминотрансфераз (АсАТ и АлАТ), в определенной степени характерен
при применении любого НПВС. Подобная реакция впервые была замечена при
использовании аспирина у пациентов с системной красной волчанкой и ювенильным
ревматоидным артритом. Случаи тяжелого идиосинкразического гепатита имели
место при применении индометацина, диклофенака, су-линдака и фенилбутазона.
Описано фатальное гепатотоксическое действие индометацина у детей; не рекомендуется
использовать этот препарат для лечения артритов у детей младше 11 лет.
Отмечались и случаи холестаза. Гепатотоксичность НПВС обычно выявляется
в первые 6 мес лечения. Поэтому необходим контроль функции печени в течение
первого месяца приема препарата и в дальнейшем — каждые 3-6 мес.
12. Какие НПВС неактивны
и должны метаболизироваться в печени для получения активных (действующих)
производных?
Сулиндак и набуметон являются
пролекарствами. Сулиндак обратимо метаболизи-руется до сульфида, сильного
ингибитора циклооксигеназы, и в дальнейшем конвертируется в исходную форму
в кишечнике и почках. Сулиндак и его метаболиты включаются в устойчивую
кишечно-печеночную рециркуляцию, с этим связан длительный период полувыведения
препарата (16-18 ч). Набуметон не является кислотой и слабо ингибирует
продукцию простагландинов. Он метаболизируется до 6-метокси-2-нафтилацетовой
кислоты, являющейся сильным ингибитором синтеза простагландинов. Набуметон
выводится печенью, а не почками, и препарат не подвергается кишечно-печеночной
рециркуляции.
13. Назовите побочные
проявления эффектов НПВС на органы ЖКТ.
Диспепсия, тошнота и рвота
Желудочно-пищеводный рефлюкс
Эрозии желудка
Пептические язвы
Желудочно-кишечные кровотечения
и перфорации
Небольшие или крупные язвы
кишечника
Диарея (особенно характерна
для меклофенамата)
Хотя появление желудочно-кишечной
симптоматики при применении НПВС наблюдается часто, около половины пациентов,
у которых возникают большие пеп-тические язвы, не предъявляют никаких жалоб.
14. Насколько часто НПВС
становятся причиной гастритов и пептических язв?
Гастриты и пептические язвы
относятся к наиболее частым побочным эффектам этих препаратов. Повреждающее
действие НПВС на желудочно-кишечный тракт ежегодно приводит к 70 000 госпитализаций
и 7000 смертей в США. Примерно у 2 % пациентов, леченных НПВС, развиваются
клинически значимые хронические пептические язвы. Мета-анализ показывает
трехкратное увеличение риска побочных желудочно-кишечных явлений при приеме
НПВС. Наиболее поражаемым отделом ЖКТ является желудок, особенно его антральный
отдел. К сожалению, обычная проба на присутствие крови в стуле малочувствительна
для выявления этих повреждений. Ущерб здоровью от желудочно-кишечных побочных
эффектов НПВС в США составляет около 3,9 млрд долл. в год.
15. В каких случаях повышается
риск развития индуцируемых НПВС желудочно-кишечных язв?
У пожилых людей (старше 60
лет)
Пептические язвы в анамнезе
(при использовании НПВС или без них)
Лечение высокими дозами НПВС
Предшествующее использование
антацидов, Н2-блокаторов или омепразола по
поводу желудочно-кишечной
симптоматики (при использовании НПВС или
без них)
Боли в животе неясной этиологии
в анамнезе (при использовании НПВС или без
них) Прогрессирование воспалительного
заболевания, по поводу которого назначен
НПВС
Сопутствующее назначение
кортикостероидов Спорные ситуации
Текущая инфекция, вызванная
Helicobacterpylori
Курение
Прием алкоголя
16. Как простагландины
защищают слизистую оболочку желудка? Каково действие НПВС на желудок? Действие
простагландинов Е( и Е2 на слизистую оболочку желудка:
• индуцируют образование
защитного поверхностного слизистого барьера;
• индуцируют выход бикарбоната;
• увеличивают кровоток в
поверхностном слое стенки желудка;
• ингибируют синтез кислоты.
Действие
НПВС на желудок:
• снижают секрецию слизи;
• уменьшают синтез бикарбоната;
• снижают кровоток в поверхностном
слое стенки желудка;
• увеличивают секрецию кислоты;
• снижают синтез глутатиона,
уменьшая тем самым утилизацию радикалов кислорода.
17. Как можно снизить
вероятность развития индуцируемых НПВС желудочных и дуоденальных язв?
1. По возможности используйте
альтернативные аналгетики.
2. Применяйте как можно меньшие
дозы НПВС.
3. При необходимости терапии
НПВС используйте неацетилированные салицила-ты (которые являются слабыми
ингибиторами простагландинов).
4. При лечении пациентов
из группы высокого риска рассмотрите возможность использования мизопростола
(аналог простагландина EI).
5. При невозможности применения
мизопростола назначьте Н2-антагонисты или омепразол для снижения
риска развития дуоденальной язвы.
6. При появлении желудочно-кишечной
симптоматики назначайте антациды, Н2-антагонисты или омепразол.
18. Вызывают ли НПВС нефротоксические
эффекты?
Простагландины оказывают
относительно слабое действие на нормальные почки при адекватном объеме
циркулирующей крови. Однако при почечной недостаточности или гиповолемическом
состоянии простагландины необходимы для поддержания адекватного гломерулярного
кровотока и давления. (Они могут расширять почечные артерии, увеличивать
выведение натрия и выделение ренина.) К нефро-токсическим эффектам НПВС
относятся:
• вазоконстрикция, снижающая
скорость клубочковой фильтрации и увеличивающая содержание креатинина в
крови;
• задержка натрия и увеличение
объема циркулирующей крови (это может быть существенным для пациентов с
пограничной застойной сердечной недостаточностью);
• папиллярный некроз;
•гиперкалиемия;
•гипонатриемия;
• острый аллергический интерстициальный
нефрит, обусловленный использованием фенопрофена;
• острый канальцевый некроз
при лечении фенилбутазоном;
• интерстициальный нефрит
в ответ на применение аспирина и фенацетина (описано несколько случаев).
19. Какие НПВС можно использовать
у пациентов с умеренной почечной недостаточностью?
Неацетилированные салицилаты
являются слабыми ингибиторами простагланди-нов и, вероятно, оказывают меньшее
действие на величину гломерулярной фильтрации. Сулиндак также имеет слабое
побочное действие на почки. В пользу применения сулиндака было то, что
он, являясь пропрепаратом, активируется до сульфида сулиндака, который
затем конвертируется почками в исходную форму, не препятствующую полезным
почечным эффектам простагландинов. Однако в ряде исследований показано,
что у пациентов с почечной недостаточностью сулиндак действует подобно
другим НПВС и не обладает никакими преимуществами. Поэтому он не является
препаратом выбора при почечной недостаточности.
20. Какие осложнения со
стороны слухового аппарата могут вызывать НПВС?
Шум в ушах является достаточно
частым осложнением при лечении салицилата-ми. Шум в ушах отмечался при
различных уровнях салицилатов в плазме, и все же его появление, как правило,
свидетельствует о превышении терапевтического уровня концентрации препарата
в плазме. Поэтому данный симптом (при невозможности контроля концентрации
препарата в плазме) используют для ее ориентировочной оценки. Высокая концентрация
салицилатов в плазме иногда не вызывает шума в ушах, но приводит к обратимым
слуховым
дефектам у детей и пожилых пациентов.
21. Действуют ли НПВС
на ЦНС?
Головные боли, головокружение,
потеря способности к концентрации внимания, деперсонализация, тремор и
психозы были описаны при лечении индометацином и, в меньшей степени, толметином.
Ибупрофен в некоторых случаях стал причиной асептического менингита, особенно
у пациентов с СКВ.
22. Пациент хорошо реагирует
на лечение индометацином, но жалуется на головную боль. Как можно уменьшить
данный эффект?
Пробенецид является
препаратом, блокирующим почечные канальцы. При его использовании увеличивается
период полусуществования в плазме индометацина, на-проксена, кетопрофена
и меклофенамата. Он также препятствует проникновению индометацина через
гематоэнцефалический барьер. Поэтому при добавлении к терапии пробенецида
удается снизить дозу индометацина примерно в 2 раза при сохранении его
эффекта и отсутствии побочного действия на ЦНС.
23. Назовите редкие побочные
эффекты НПВС.
1. Лихорадка — ибупрофен.
2. Волчаночный синдром —
фенилбутазон, ибупрофен.
3. Васкулит — индометацин,
напроксен.
4. Медиастинальная лимфаденопатия
— сулиндак.
5. Перикардит, миокардит
— фенилбутазон.
6. Апластическая анемия —
большинство НПВС, особенно фенилбутазон.
7. Изолированная эритроцитарная
аплазия — фенилбутазон, индометацин, фенопрофен.
8. Тромбоцитопения — большинство
НПВС.
9. Нейтропения — большинство
НПВС.
10. Гемолитическая анемия
— мефенамовая кислота, ибупрофен, напроксен.
11. Стоматит — большинство
НПВС.
12. Кожные эффекты (фоточувствительность,
полиморфная эритема, крапивница, токсический эпидермальный некролиз) —
большинство НПВС, особенно пироксикам.
13. Асептический менингит
(особенно у пациентов с СКВ) — ибупрофен, реже другие НПВС.
24. Каковы периоды полувыведения
различных НПВС?
|
|
|
|
|
|
ПРЕПАРАТ
|
ПЕРИОД ПОЛУВЫВЕДЕНИЯ
(ч)
|
ДОЗИРОВКА
|
|
|
Короткий
период полувыведения (< 6 ч)
|
|
|
|
|
Аспирин
|
0,25
|
|
|
|
Диклофенак
|
1,1
|
25-50 мг
2-3 раза/день 75 мг 2 раза/день
|
|
|
Этодалак
|
3,0/6,5*
|
200 мг 3-4
раза/день 400 мг 3 раза/день
|
|
|
Фенопрофен
|
2,5
|
200-600 мг
3-4 раза/день
|
|
|
Флурбипрофен
|
3,8
|
50-100 мг
2-3 раза/день
|
|
|
Ибупрофен
|
2,1
|
300-800 мг
3-4 раза/день
|
|
|
Индометацин
|
4,7
|
25 мг 3-4
раза/день 50 мг 3 раза/день 75 мг SR 2 раза/день
|
|
|
Кетопрофен
|
1,8
|
50 мг 4 раза/день
75 мг 3 раза/день 200 мг ER 1 раз/день
|
|
|
Толметин
|
1,0/6,8*
|
400-600 мг
3 раза/день
|
|
|
Длинный период
полувыведения (> 10 ч)
|
|
|
|
|
Дифлунизал
|
13
|
250-500 мг
2 раза/день
|
|
|
Набуметон
|
26
|
500-1000
мг 2 раза/день 1000-2000 мг 1 раз/день
|
|
|
Напроксен
|
14
|
250-500 мг
2 раза/день
|
|
|
Оксапрозин
|
58
|
600-1200
мг 1 раз/день
|
|
|
Фенилбутазон
|
68
|
100-400 мг
1 раз/день 100 мг 3-4 раза/день
|
|
|
Пироксикам
|
57
|
10-20 мг
1 раз/день
|
|
|
Салицилат
|
2-15**
|
|
|
|
Сулиндак
|
14
|
150-200 мг
2 раза/день
|
|
|
|
|
|
|
* Выведение препарата осуществляется
в 2 фазы, наиболее важной является первая.
** Выведение препарата зависит от дозы.
Наибольшее количество жалоб
наблюдается при одно- или двукратном приеме препаратов. Препараты с длительным
периодом полувыведения могут иметь преимущество при утренних болях и скованности.
25. Назовите формы выпуска
НПВС.
1. Таблетки, растворяющиеся
в кишечнике. Такая форма аспирина разработана для уменьшения желудочно-кишечной
симптоматики, однако на практике не выявлено снижения частоты возникновения
гастрита или пептических язв по сравнению с обычной формой.
2. Жидкие формы. Ибупрофен,
напроксен, холина магния трисалицилат и индо-метацин выпускаются в жидком
виде, предназначенном для пациентов, имеющих затруднения с проглатыванием
таблеток, и для детей.
3. Медленно высвобождающиеся
формы. Предназначены для увеличения периода полувыведения препаратов
с коротким сроком действия, чтобы эти препараты можно было принимать 2
раза (индометацин SR) или 1 раз в день (кетопрофен ER).
26. Какие НПВС можно использовать
у детей?
Салицилаты, ибупрофен, напроксен
и толметин одобрены FDA для использования у детей в США.
27. Нужна ли предосторожность
при назначении НПВС пожилым людям?
Ревматические заболевания
нередко встречаются у пожилых людей, и в данной группе пациентов часто
используются НПВС. У пожилых чаще возникают различные осложнения по сравнению
с другими возрастными группами вследствие следующих причин:
• изменение абсорбции препаратов.
рН в желудке повышается с возрастом. Активная абсорбция и транспорт препаратов
могут меняться;
• редуцированное распределение
препаратов в организме;
• снижение связывания препаратов
с белками плазмы. Содержание альбуминов в плазме уменьшается у пожилых
пациентов;
• печеночный метаболизм и
почечная экскреция могут изменяться;
• использование нескольких
различных препаратов. Иногда пациенты принимают другие лекарственные средства,
которые могут взаимодействовать с НПВС. Для снижения риска, связанного
с использованием НПВС у пожилых людей, необходимо соблюдать следующие правила:
• не назначайте НПВС, когда
в них нет необходимости. Не продолжайте лечение дольше, чем нужно;
• увеличивайте дозу с осторожностью;
• знайте препараты, имеющие
высокий риск развития осложнений;
• знайте пациентов с высоким
риском развития побочных эффектов;
• тщательно наблюдайте за
состоянием пожилых пациентов, принимающих НПВС.
28. Новые НПВС могут превосходить
по эффективности существующие. Расскажите об этом с позиций механизмов
регуляции простагландинсинтетазы Н (циклооксигеназы).
Имеются по крайней мере 2
изоформы циклооксигеназы, активность которых регулируется и проявляется
по-разному. Продукты простагландин-Н-синтетазы 1, или циклооксигеназы 1,
образуются в норме и вовлечены в обычные клеточные процессы. Их образование
стимулируется гормонами или факторами роста и необходима для формирования
защитного слизистого слоя желудка. Образование продуктов простагландин-Н-синтетазы
2, или циклооксигеназы 2, стимулируется в лейкоцитах и фибробластах воспалительным
процессом. В обычном состоянии, пока их синтез не стимулируется воспалением,
они отсутствуют. Новые НПВС способны ингибиро-вать образование продуктов
циклооксигеназы 2, не влияя на функцию циклооксигеназы 1. Таким образом,
будет достигнуто положительное противовоспалительное действие без серьезных
побочных эффектов.
29. Расскажите о взаимодействии
НПВС с другими лекарственными средствами. НПВС, действующие на другие препараты
|
|
|
|
|
|
ПРЕПАРАТ
|
НПВС
|
ЭФФЕКТ
|
|
|
Варфарин
|
Фенилбутазон
|
Ингибирует
метаболизм варфарина, увеличивая антикоагу-лянтный эффект
|
|
|
|
Все НПВС
|
Увеличивают
риск кровотечения за счет ингибирования тромбоцитарных функций и повреждения
слизистой оболочки желудка
|
|
|
Сульфонил-мочевина
|
Фенилбутазон
|
Ингибирует
метаболизм сульфонилмочевины, увеличивая риск развития гипогликемии
|
|
|
|
Высокие дозы
салицилатов
|
Потенцируют
гипогликемию
|
|
|
3-Блокаторы
|
Все НПВС,
ингиби-рующие проста-гландины
|
Снижают гипотензивный,
но не действуют на отрицательные хронотропный и инотропный эффекты
|
|
|
Гидралазин
Празозин Ингибиторы АПФ
|
Тоже
|
Нейтрализуют
гипотензивные эффекты
|
|
|
Диуретики
|
Тоже
|
Нейтрализуют
натрийуретический, диуретический, гипотензивный эффекты фуросемида; натрийуретический
эффект спиронолактона; гипотензивный, но не натрийуретический и диуретический
эффекты тиазидов
|
|
|
Фенитоин
|
Фенилбутазон
|
Ингибирует
метаболизм, увеличивая концентрацию в плазме и, соответственно, риск токсического
действия
|
|
|
|
Другие НПВС
|
Конкурируют
с фенитоином за связи с белками плазмы, снижая необходимую общую концентрацию
для достижения той же активной концентрации препарата
|
|
|
Литий
|
Большинство
НПВС
|
Увеличивают
концентрацию лития в плазме
|
|
|
Дигоксин
|
Большинство
НПВС
|
Могут увеличивать
концентрацию дигоксина в плазме
|
|
|
Аминогликозиды
|
Большинство
НПВС
|
Могут увеличивать
концентрацию аминогликозидов в плазме
|
|
|
Метотрексат
|
Большинство
НПВС
|
Могут увеличивать
концентрацию метотрексата в плазме
|
|
|
Вальпроат
натрия
|
Аспирин
|
Ингибирует
метаболизм вальпроата, увеличивая его содержание в плазме
|
|
|
|
|
|
|
Другие препараты, действующие на
НПВС
|
|
|
|
|
|
ПРЕПАРАТ
|
НПВС
|
ЭФФЕКТ
|
|
|
Антациды
|
Индометацин
Салицилаты Другие НПВС?
|
Алюминийсодержащие
антациды снижают скорость и степень абсорбции. Бикарбонат натрия увеличивает
скорость и степень абсорбции
|
|
|
Циметидин
|
Пироксикам
|
Увеличивает
концентрацию в плазме и период полувыведения пироксикама
|
|
|
Пробенецид
|
Большинство
НПВС
|
Снижает метаболизм
и почечный клиренс НПВС
|
|
|
Холестирамин
|
Напроксен
Возможно, другие НПВС
|
Ионообменная
смола связывает НПВС в кишечнике, снижая скорость (и степень?) абсорбции
|
|
|
Кофеин
|
Аспирин
|
Увеличивает
скорость абсорбции аспирина
|
|
|
Метоклопрамид
|
Аспирин и,
возможно, другие НПВС
|
Увеличивает
скорость и степень абсорбции у пациентов с мигренями
|
|
|
|
|
|
|
Избранная литература
Clements P. J., Paulus H.
E. Nonsteroidal anti-inflammatory drugs (NSAIDs). In: Kelly W. N., Hams
E. D., Ruddy S., Sledge С. В. (eds). Textbook of Rheumatology, 4th ed.
Philadelphia, W. B. Saunders, 1993,700-730.
Huskisson E. C. How to choose
a non-steroidal anti-inflammatory drug. Rheum. Dis. Clin. North Am., 10:313-323,1984.
Brooks P. M., Day R. O. Nonsteroidal
antiinflammatory drugs — Differences and similarities. N. Engl. J. Med.,
324:1716-1725, 1991.
Simon L. S., Goodman T. NSAID-induced
gastrointestinal toxicity. Bull. Rheum. Dis., 44: 1-5, 1995.
Hollander D. Gastrointestinal
complications of nonsteroidal anti-inflammatory drugs: Prophylactic and
therapeutic strategies. Am. J. Med., 96: 274-281,1994.
Tolman K. G. Hepatotoxicity
of antirheumatic drugs. J. Rheumatol., 17: 6-11,1990.
Rodriguez L. A. G., Williams
R., Derby L. E. et al. Acute liver injury associated with nonsteroidal
antiinflammatory drugs and the role of risk factors. Arch. Intern. Med.,
154:311-316,1994.
Scheiman J. M. Pathogenesis
of gastroduodenal injury due to nonsteroidal antiinflammatory drugs. Implications
for prevention and therapy. Semin. Arthritis Rheum., 21: 201-210, 1992.
Webster J. Interactions of
NSAIDs with diuretics and beta-blockers: Mechanisms and clinical implications.
Drugs, 30: 32-41,1985.
O'Brien W. M., Bagby G. F.
Rare adverse reactions to nonsteroidal antiinflammatory drugs (pts I and
II). J. Rheumatol., 12:13-20,347-353,1985.
Clive D. M., Stoff J. S.
Renal syndromes associated with nonsteroidal antiinflammatory drugs. N.
Engl. J. Med., 310: 563-572,1984.
Garella S., Matarese R. A.
Renal effects of prostaglandins and clinical adverse effects of nonsteroidal
antiinflammatory agents. Medicine, 63:165-181,1984.
Abramson S. В., Weissmann
G. The mechanisms of action of nonsteroidal antiinflammatory drugs. Arthritis
Rheum., 32:1-9,1989.
Morgan J., Furst D. E. Implications
of drug therapy in the elderly. Rheum. Dis. Clin. North Am., 12:227-244,1986.
ГЛАВА 85. ГЛЮКОКОРТИКОИДЫ
- СИСТЕМНЫЕ И ВВОДИМЫЕ МЕСТНО
Gregory J. Dennis, M.D.
1. Каковы общие показания
к глюкокортикоидной терапии?
Глюкокортикоиды, или кортикостероиды,—
это сильные лекарственные препараты, нередко используемые в различных клинических
ситуациях. При ревматических заболеваниях имеется два основных показания
к применению кортикостероидов:
1. Подавление воспалительного
процесса.
2. Модификация иммунного
ответа.
2. Какие формы кортикостероидной
терапии применяются при ревматических заболеваниях?
К общепринятым эффективным
методам кортикостероидной терапии при ревматических заболеваниях относятся:
1. Интросиновиальная терапия
(инъекция в сустав, суставную сумку или сухожильное влагалище) обычно используется
для контроля воспалительных реакций, вовлекающих синовиальную оболочку
сустава.
2. Оральная, или алиментарная,
терапия.
3. Парентеральная терапия:
внутримышечная и внутривенная.
3. Какие важнейшие факторы
необходимо учитывать перед началом кортикостероидной терапии?
Следует учитывать следующие
факторы:
• наличие хронических инфекций;
• снижение толерантности
к глюкозе, больные диабетом среди родственников;
• наличие остеопороза;
• пептические язвы, гастрит,
эзофагит;
• сердечно-сосудистая патология,
артериальная гипертензия;
• нарушения психики.
При наличии этих факторов
не исключают использование кортикостероидов, но требуется более пристальное
внимание к пациенту из-за повышенной вероятности развития специфических
побочных эффектов.
4. Как перед началом кортикостероидной
терапии определить исходное значение каждого из перечисленных факторов?
Некоторые хронические инфекции,
не выявляющиеся при первичном физикальном обследовании, прогрессируют на
фоне кортикостероидной терапии. К примеру, туберкулез и грибковые заболевания
являются нередкими формами легочных инфекций вследствие иммунодефицита.
Для определения исходного состояния необходимо выполнить рентгенографию
грудной клетки и кожный туберкулиновый тест.
Предрасположенность к нарушению
переносимости глюкозы является важным моментом при оценке вероятности
развития диабета на фоне стероидной терапии. Перед ее началом выполняют
тест с нагрузкой глюкозой с последующим периодическим его повторением,
особенно при длительном лечении.
Побочные явления, обусловленные
остеопорозом,
могут
возникать поразительно быстро после начала кортикостероидной терапии. Для
оценки риска их развития у всех пациенток в постменопаузе необходимо выполнять
рентгенографию
позвоночника. При выявлении каких-либо аномалий проводят костную минеральную
ден-ситометрию и профилактическую терапию.
Активность эрозивного
процесса в ЖКТ может усиливаться кортикостероидны-ми средствами. Перед
началом глюкокортикоидной терапии необходимо выполнить анализ кала на
наличие крови и клинический анализ крови с определением гемато-критного
числа.
Сердечно-сосудистые заболевания
и артериальная гипертензия могут усугубляться кортикостероидными препаратами,
поэтому следует определить кровяное давление, а также проверить
наличие периферических отеков при физикальном обследовании до и на фоне
кортикостероидной терапии.
Наконец, необходимо, особенно
у пациентов с психическими нарушениями в анамнезе, провести минимальное
исследование психического статуса и оценить его исходно для последующего
контроля на фоне терапии кортикостероидами.
5. Всегда ли кортикостероидная
терапия является основным методом лечения ревматических заболеваний?
Да, при некоторых из них.
В целом, ревматические заболевания, при которых первично используются стероиды,
классифицируются как соединительнотканные заболевания. К подобной патологии
относятся:
• ревматическая полимиалгия;
• полимиозит/дерматомиозит;
• васкулиты;
• отдельные осложнения, связанные
с соединительно-тканными заболеваниями (ревматоидный артрит, СКВ, болезнь
Шегрена).
6. Влияет ли схема приема
кортикостероидов на их эффективность?
Да. Эффективность кортикостероидной
терапии клинически коррелирует с продолжительностью супрессии гипоталамо-гипофизарной
системы. По возрастанию суп-рессивного действия на эту систему схемы
кортикостероидной терапии распределяются следующим образом:
1. Интермиттирующий прием
внутрь.
2. Прием через день.
3. Однократный ежедневный
прием препарата.
4. Интермиттирующая внутривенная
пульс-терапия.
5. Прием препарата несколько
раз в день.
7. Используются ли кортикостероидные
препараты при лечении ревматических заболеваний, не относящихся к соединительно-тканным?
Да, но в форме местной терапии.
Для локальной терапии используются различные формы кортикостероидов, но
инъекция препарата остается наиболее действенным методом его введения в
мышечно-скелетные структуры. К специфическим состояниям, при которых инъекции
кортикостероидов особенно эффективны, относятся:
1. Лечение бурситов пункцией
в суставную сумку.
2. Инъекции в сухожильные
влагалища при тендинитах.
3. Внутрисуставные инъекции
при синовитах.
4. Инъекции в триггерные
точки мягких тканей.
8. Как классифицируются
кортикостероиды по их биологической активности?
В соответствии с длительностью
биологической активности кортикостероиды можно разделить на три группы.
Препараты
короткого действия (период полувыведения < 12 ч)
Гидрокортизон
Кортизон Препараты с промежуточной
длительностью действия (период полувыведения 12-36 ч)
Преднизон
Преднизолон
Метилпреднизолон
Триамцинолон Препараты
длительного действия (период полувыведения > 48 ч)
Параметазон
Бетаметазон
Дексаметазон
9. Что определяет выбор
препарата для инъекционной терапии?
При выборе препарата для
инъекционной терапии определяющим фактором является растворимость кортикостероидов.
Ее снижение увеличивает продолжительность локального эффекта препарата,
так как при этом наблюдается более медленная его диффузия. Менее растворимые
препараты имеют большую эффективность, но чаще вызывают побочные эффекты.
10. Назовите свойства
кортикостероидных препаратов, определяющих их использование.
• Биологический период полувыведения.
• Минералокортикоидные эффекты.
• Необходимость конверсии
в биологически активные производные.
• Форма препарата.
• Стоимость.
11. Какие кортикостероиды
вызывают наименьшую задержку натрия?
Задержка натрия зависит от
минералокортикоидного действия, которое незначительно при использовании
обычных дозировок метилпреднизолона, триамцинолона, параметазона, бетаметазона
и дексаметазона.
Минералокортикоидные свойства глюкокортикоидных
препаратов
|
|
|
|
|
ГЛЮКОКОРТИКОИД
|
МИНЕРАЛОКОРТИКОИДНЫЙ
ЭФФЕКТ'
|
|
|
Короткого
действия
|
|
|
|
Гидрокортизон
|
1
|
|
|
Кортизон
|
0,8
|
|
|
Промежуточной
длительности действия
|
|
|
|
Преднизон
|
0,25
|
|
|
Преднизолон
|
0,25
|
|
|
Метилпреднизолон
|
±
|
|
|
Триамцинолон
|
+
|
|
|
Длительного
действия
|
|
|
|
Параметазон
|
+
|
|
|
Бетаметазон
|
+
|
|
|
Дексаметазон
|
+
|
|
|
|
|
|
' Эффект выражен в сравнении с кортизолом,
значение которого принято за 1.
12. Сравните глюкокортикоидные
свойства кортикостероидов и кортизола. Глюкокортикоидные свойства кортикостероидных
препаратов
|
|
|
|
|
ГЛЮКОКОРТИКОИД
ГЛКЖОКОРТИКОИДНЫЙ ЭФФЕКТ1
|
|
|
Короткого
действия
|
|
|
|
Гидрокортизон
|
1
|
|
|
Кортизон
|
0,8
|
|
|
Промежуточной
длительности действия
|
|
|
|
Преднизон
|
4
|
|
|
Преднизолон
|
4
|
|
|
Метилпреднизолон
|
5
|
|
|
Триамцинолон
|
5
|
|
|
Длительного
действия
|
|
|
|
Параметазон
|
10
|
|
|
Бетаметазон
|
25
|
|
|
Дексаметазон
|
30-40
|
|
|
|
|
|
1В сравнении с кортизолом,
значение которого принято за 1.
13. Каковы побочные эффекты
кортикостероидной терапии?
Нарушение толерантности к
глюкозе
Мышечная слабость
Кожные проблемы (синяки,
стрии,
замедленное заживление ран)
Ожирение Пептические язвы Остеопороз
Замедление роста
Образование катаракты
Гирсутизм
Инфекции
Нарушение менструаций
Психические нарушения
14. Почему необходимо
проводить кожный тест реактивности пациента к туберкулину до начала лечения
кортикостероидами?
При непрерывной терапии кортикостероидами
в фармакологических дозах имеется большая вероятность супрессии клеточного
ответа на кожный тест в течение первых 2 нед. Кроме того, измененный клеточный
ответ может действовать на туберкулиновую реактивность. Поэтому отрицательные
результаты кожного теста, полученные во время кортикостероидной терапии,
не надежны, даже если контрольный кожный тест был положителен.
15. Насколько часто возникает
атрофия надпочечников у пациентов, получающих глкжокортикоиды?
Глюкокортикоидная терапия
является наиболее частой причиной надпочечнико-вой недостаточности, обусловленной
супрессией выделения адренокортикотроп-ного гормона (АКТГ). При полном
отсутствии АКТГ кора надпочечников у человека начинает атрофироваться через
1 нед. Лечение АКТГ-супрессивными дозами кортикостероида может приводить
к функциональной атрофии коры надпочечников, поскольку такие пациенты не
способны реагировать на стрессовые ситуации (инфекция, травма, хирургическое
вмешательство) адекватным выделением кортизола (до 200-300 мг/сут). Для
нормального поступления кортизола в периоды физиологического стресса необходимо
проводить соответствующую замещающую терапию.
16. Каковы низкие, средние
и высокие суточные дозы преднизона при лечении ревматических заболеваний?
|
|
|
|
|
Низкие
дозы: Средние дозы: Высокие дозы:
|
<
15 мг/сут
15-40 мг/сут
> 40 мг/сут
|
|
|
|
|
|
17. Как минимизировать
риск супрессии гипоталамо-гипофизарно-адреналовой системы при лечении кортикостероидами?
Естественная секреция кортизола
у человека имеет определенный циркадный ритм с пиковым уровнем в утренние
часы, поэтому прием кортикостероидов в это время оказывает менее выраженное
супрессивное действие на выделение рилизинг-факто-ра кортизола. Прием глюкокортикоидов
до 10:00 утра имеет наименьший подавляющий эффект на гипоталамо-гипофизарно-адреналовую
систему.
18. Каковы основные преимущества
интрасиновиальной инъекции кортикостероида?
• Уменьшение воспаления в
суставе, суставной сумке или сухожильном влагалище.
• Отсутствие побочных системных
эффектов.
19. Каковы общие показания
к инъекционной кортикостероидной терапии при ревматических заболеваниях?
1. Наличие на фоне полиартикулярной
патологии гораздо более выраженного по сравнению с другими суставами изолированного
воспаления сустава (после устранения суставной инфекции).
2. Рецидивирующее образование
экссудата в суставе.
3. Воспаление сухожильного
влагалища.
4. Бурсит или тендинит, рефрактерные
к НПВС.
5. Неинфекционный моноартрит.
20. При каких заболеваниях
показана кортикостероидная инъекционная терапия (на любом этапе их развития)?
• Ревматоидный артрит.
• Болезнь отложения кристаллов.
• Системная красная волчанка.
• Острый травматический артрит.
• Остеоартрит.
• Плечевой тендинит/бурсит.
• Синдром Титца.
• Серонегативные спондилоартропатии.
21. В каком объеме кортикостероидный
препарат можно безопасно вводить в сустав?
Это зависит от размера сустава.
Врач должен знать объем препарата, который можно инъецировать в определенный
сустав, и соблюдать все предосторожности, чтобы избежать перерастяжения
окружающей сустав капсулы.
|
|
|
|
|
РАЗМЕР СУСТАВА
|
ОБЪЕМ (мл)
|
|
|
Большой (коленный,
голеностопный, плечевой) Средний (локтевой, кистевой) Мелкий (межфаланговый,
метафаланговый)
|
1-2 0,5-1
0,1-0,5
|
|
|
|
|
|
22. Какие инъекционные
формы кортикостероидных препаратов применяются для введения в сустав, суставную
сумку или сухожильное влагалище?
|
|
|
|
|
|
ПРЕПАРАТ
КОНЦЕНТРАЦИЯ (мг/мл)
|
ПРЕДНИЗОНОВЫЙ
ЭКВИВАЛЕНТ (мг)'
|
|
|
Короткого
действия, растворимые
|
|
|
|
|
Дексаметазона
натрия фосфат (Decadron, Hexadrol)
|
4
|
40
|
|
|
Гидрокортизона
ацетат (Hydrocortone)
|
25
|
5
|
|
|
Длительного
действия, менее растворимые
|
|
|
|
|
Преднизолона
тебутат (Hydeltra-TBA)
|
20
|
20
|
|
|
Метилпреднизолона
ацетат (Depo-Medrol)
|
20, 40, 80
|
25,50, 100
|
|
|
Дексаметазона
ацетат (Decadron-LA)
|
8
|
80
|
|
|
Самого длительного
действия, наименее растворимые
|
|
|
|
|
Триамцинолона
ацетонид (Kenalog, Aristocort)
|
10,40
|
12,5; 50
|
|
|
Триамцинолона
гексацетонид (Aristospan)
|
20
|
25
|
|
|
Бетаметазона
натрия фосфат/ацетат (Celestone, Soluspan)
|
6
|
50
|
|
|
|
|
|
|
1 Эквивалент 1 мл инъекционного
стероидного препарата.
23. От чего зависит оптимальная
доза кортикостероида при инъекции в синовиаль ное пространство?
Доза кортикостероида для
введения в синовиальную полость зависит от следующи: факторов:
1. Размер сустава.
2. Степень воспаления.
3. Количество жидкости в
суставе.
4. Концентрация кортикостероида.
24. Какой кортикостероидный
препарат и в какой дозе необходимо инъецировать i
сустав, суставную сумку или
сухожильное влагалище? (Спорно.) Обычно рекомендуется инъецировать
в сухожильное влагалище кортикостерощц короткого или длительного действия,
так как они более растворимые, вызывают ме нее выраженную атрофию тканей
и имеют меньшую вероятность разрыва сухожи лия. Кортикостероиды самого
длительного действия более эффективны при введе нии в воспаленные суставы.
Рекомендации по адекватным дозам
инъецируемого кортикостероида
|
|
|
|
|
МЕСТО ВВЕДЕНИЯ
ДОЗА ПРЕДНИЗОНОВОГО ЭКВИВАЛЕНТА (мг)
|
|
|
Суставная
сумка Сухожильное влагалище Мелкие суставы рук и ног Средние суставы (кистевой,
локтевой) Большие суставы (коленный, плечевой, голеностопный)
|
10-20 10-20
5-15 15-25 20-50
|
|
|
|
|
|
25. Как часто можно инъецировать
кортикостероидные препараты в сустав или сухожильное влагалище?
Основной опасностью частых
инъекций является прогрессирующее ухудшение функции сустава вследствие
атрофии хряща или ослабление сухожилия с риском его разрыва. Чем длиннее
интервал между инъекциями, тем лучше. Рекомендуется минимальный интервал
между инъекциями 4-6 нед. В суставы, на которые приходится нагрузка массы
тела, нельзя вводить препраты чаще чем!разв6-12 нед. В один и тот же сустав
или сухожильное влагалище не следует инъецировать кортикостероид чаще 3
раз в год.
26. Можно ли для минимизации
количества уколов вводить кортикостероид и ане-стетик в одной инъекции?
Да, анестезирующие препараты
можно смешивать с кортикостероидами. Однако, если кортикостероидный препарат
содержит в качестве консерванта парабен (paraben), не исключено при смешивании
образование хлопьев в суспензии.
27. Каковы возможные осложнения
и последствия инъекций кортикостероидов?
1. Инфекция.
2. Стероидный кристалл-индуцируемый
синовит (постинъекционное обострение).
3. Гипопигментация.
4. Атрофия подкожных тканей.
5. Разрыв сухожилия.
28. Существуют ли противопоказания
к интрасиновиальным инъекциям кортикостероидов?
Врач должен знать о противопоказаниях
к инъекции кортикостероида (относительных или абсолютных), чтобы решить,
действительно ли инъекция принесет пользу пациенту. Следующие ситуации
требуют серьезного обсуждения перед инъекцией кортикостероида:
• периартикулярное и суставное
нагноение;
• бактериемия;
• нестабильность сустава;
• недоступность суставов;
• отсутствие реакции на предыдущие
инъекции;
• нарушения тромбообразования;
• внутрисуставной перелом.
29. Каковы механизмы противовоспалительных
эффектов кортикостероидов?
Стероиды оказывают противовоспалительное
действие с помошыо нескольких механизмов. Наиболее важными являются следующие:
• снижение миграции и накопления
нейтрофилов в области воспаления;
• ингибирование нейтрофильного
и макрофагеального фагоцитоза, выброса ферментов и продукции провоспалительных
цитокинов (особенно интерлей-кина-1 и фактора некроза опухоли);
• индуцирование липокортина
и липомодулина, снижающих синтез арахидоно-вой кислоты с соответствующим
уменьшением продукции простагландинов и лейкотриенов;
• уменьшение пролиферации
Т-клеток, синтеза и секреции интерлейкина-2.
Избранная литература
Axelrod L. Glucocorticoid
therapy. Medicine, 55: 39, 1976.
Baxter J. D. The effects
of glucocorticoid therapy. Hosp. Pract., 27: 111-134, 1992.
Chrousos G. P. The hypothalamic
pituitary-adrenal axis and immune-mediated inflammation N. Engl. J. Med.,
332:1351-1362, 1995.
Cupps T. R. Therapeutic use.
In: Boumpas D.T (moderator)' Glucocorticoid therapy for immune-mediated
diseases: Basic and clinical correlates Ann. Intern. Med., 119-1198-1208,1993
Fauci A S., Dale D. С , Balow
J. E. Glucocorticoid therapy: Mechanisms of action and clinical considerations.
Ann. Intern Med., 44. 304-315,1976.
Paulus H. E., Bulpitt K.
J. Nonsteroidal antimflammatory agents and corticosteroids In Schumacher
H. R. Jr. (ed.). Primer on the Rheumatic Diseases, 10th ed Atlanta, Arthritis
Foundation, 1993,300-304,310-311.
ГЛАВА 86. СИСТЕМНЫЕ
АНТИРЕВМАТИЧЕСКИЕ ПРЕПАРАТЫ
James О'Dell, M.D.
Если для лечения болезни используется
много препаратов,
все они неэффективны. Уильям
Ослер
1. Что означают применительно
к ревматоидному артриту термины "модифицирующий болезнь препарат" или "индуцирующий
ремиссию препарат"?
Излечить ревматоидный артрит
нельзя, поэтому целью терапии является поддержание фазы ремиссии. Для обозначения
категории препаратов, способных хотя бы в некоторой степени выполнить эту
задачу, использовались различные термины
• модифицирующие болезнь
антиревматические препараты (МБАРП);
• индуцирующие ремиссию препараты;
• препараты второго уровня;
• антиревматические препараты
медленного действия.
Но все они не совсем точны.
Модифицирующие
болезнь препараты — неправильное название, так как эти препараты не
всегда модифицируют заболевание, по крайней мере не у всех пациентов. Термин
"индуцирующие
ремиссию препараты" содержит очевидное противоречие, поскольку индуцируемые
препаратами ремиссии при ревматоидном артрите наблюдаются редко. Название
"препараты
второго уровня" как бы подразумевает, что эти лекарственные средства
используются в терапии после других. Препараты медленного действия —
описательное
понятие, так как для развития эффекта большинства этих лекарств требуются
месяцы, но такое название не вызывает у пациентов или врачей уверенности
в улучшении состояния.
2. Назовите препараты, относящиеся
к категории модифицирующих болезнь при лечении ревматоидного артрита.
Препараты золота для внутримышечного
введения (солганал — Solganal, мио-
кризин — Myochrysine) Противомалярийные
препараты (гидроксихлорохин — hydroxychloroqume
[плаквенил — Plaquenil],
хлорохин — Chloroquine [арален — Aralen])
Сульфасалазин — Sulfasalazine
(азулфидин — Azulfidine)
D-пеницилламин — D-penicillamine
(купрамин — Cupramine, ди-пэн — DePen)
Препараты золота для приема
внутрь — ауранофин — auranofin (ридаура —
Ridaura)
Метотрексат — Methotrexate
(ревматрекс — Rheumatrex) Азатиоприн — Azathioprine (имуран — Imuran) Циклоспорин
— Cyclosporine (сандиммун — Sandimmune, неорал — Neoral)
3. Какие МБАРП наиболее
эффективны при ревматоидном артрите?
Самые эффективные: метотрексат;
препараты золота для внутримышечного
введения; сульфасалазин; D-пеницилламин; азатиоприн.
Умеренно эффективные: антималярийные
(гидроксихлорохин, хлорохин). Слабоэффективные: препараты золота для приема
внутрь. Мета-анализ показал сходную эффективность большинства модифицирующих
болезнь антиревматических препаратов при коротком сроке наблюдения. Антималярийные
и препараты золота для приема внутрь слабее других, но достоверно эффективнее
плацебо. Эффективность препаратов золота составляет примерно 40 %, антималярийных
— примерно 55 %. Метотрексат — первый в данном списке, поскольку в сравнении
с другими МБАРП его действие значительно дольше.
4. Какие МБАРП наиболее
токсичны?
В порядке убывания токсичности
препараты располагаются следующим образом:
препараты золота для внутримышечного
введения;
сульфасалазин;
D-пеницилламин;
метотрексат;
препараты золота для приема
внутрь;
антималярийные препараты.
Почти все побочные эффекты
сульфасалазина обусловлены незначительным нарушением функции ЖКТ. Поэтому,
с учетом тяжести побочных эффектов, его можно поставить в данном списке
после препаратов золота для приема внутрь.
5. Каковы цели терапии
при ревматоидном артрите?
1. Сделать все для того,
чтобы пациент смог как можно раньше свободно функционировать.
2. Быть уверенным,
что эффективность терапии достаточна для прекращения или задержки прогрессирования
повреждения и деструкции суставов, чтобы они продолжали функционировать
в течение многих лет.
6. Когда следует назначать
МБАРП пациенту с ревматоидным артритом? Показания к терапии МБАРП при ревматоидном
артрите
Проявления активности заболевания (синовит,
утренняя скованность и т. д ) Прогрессирование костных эрозий или деформаций
Внесуставная симптоматика
Эрозии и/или деформации суставов
обычно необратимы. Поэтому очень важно, чтобы терапия была начата как можно
раньше во избежание их появления. Как только установлен диагноз ревматоидного
артрита (обычно через 6 нед-6 мес после появления симптоматики), большинство
ревматологов начинают лечение МБАРП по указанным выше показаниям.
7. Когда можно ожидать
эффекта от лечения МБАРП?
При назначении МБАРП важно
проинформировать пациента о возможном сроке реакции на проводимое лечение.
Для большинства МБАРП необходимо несколько месяцев до достижения заметного
эффекта. Если пациенты ожидают, что таблетки, которые им дали сегодня,
улучшат их состояние уже завтра, они могут оказаться очень разочарованными
и выскажут свои претензии.
8. Каковы основные побочные
эффекты при введении золота внутримышечно?
Нитритоподобная реакция (10-15
%)
Кожная сыпь (10-15 %)
Протеинурия (3-4 %)
Гематологические реакции
(1-2 %)
Нитритоподобная реакция выражается
в ощущении прилива крови и гипотензии, наблюдающихся в пределах 15-30 мин
после введения препарата (обычно миокри-зина).
9. Опишите стандартный
протокол лечения золотом, вводимым внутримышечно.
Терапию обычно начинают с
тестирующей дозы (10 мг внутримышечно). Если не наблюдается каких-либо
нежелательных реакций, то через 1 нед вводят 25-50 мг (в большинстве случаев
50 мг). Затем еженедельные инъекции по 50 мг препарата повторяют до достижения
эффекта. Если общая введенная доза золота достигает 1 г без заметного улучшения
состояния пациента, лечение обычно прекращают как неэффективное. При улучшении
состояния пациента частоту инъекций уменьшают до 1 раза в 2-3 нед, иногда
до 1 раза в месяц. Если при увеличении интервала между инъекциями наблюдается
обострение заболевания, то частоту инъекций надо увеличить.
10. Какие лабораторные
тесты необходимо выполнять на фоне лечения золотом?
Перед каждой инъекцией препаратов
золота рекомендовано выполнить клинический анализ крови с подсчетом количества
тромбоцитов и оценить протеинурию. Если наблюдаются значительное падение
количества лейкоцитов, тромбоцитов или выраженная протеинурия (обычно >
2+), лечение, вероятно, следует прекратить.
11. Как используется золото
для приема внутрь в терапии ревматоидного артрита? Отличается ли оно от
внутримышечной формы?
Форма: капсулы, содержащие
3 мг препарата.
Побочные эффекты: диарея,
сыпь, протеинурия, депрессия костного мозга.
Дозировка: внутрь 3-9 мг/сут.
Наблюдение: ежемесячно клинический
анализ крови с подсчетом количества
тромбоцитов, оценка протеинурии.
Основные проблемы, возникающие
при лечении препаратами золота,— непереносимость со стороны ЖКТ, в основном
— диарея, развивающаяся у 5 % пациентов. Препараты энтерального
введения потенциально вызывают сыпь, протеинурию и депрессию костного мозга
так же как и средства для внутримышечного введения; но эти проявления побочного
действия наблюдаются все же не так часто.
12. Как используются противомалярийные
препараты для лечения ревматоидного артрита?
|
|
|
|
|
Форма:
Побочные эффекты: Дозировка:
Наблюдение:
|
гидроксихлорохин
— таблетки по 200 мг; хлорохин — таблетки по 250 и 500 мг. тошнота, рвота,
сыпь, нарушения зрения (редко), гидроксихлорохин — 200-400 мг/сут; хлорохин
— 250 мг/сут. осмотр офтальмологом каждые 6 мес.
|
|
|
|
|
|
Противомалярийные препараты
являются наименее токсичными из всех МБАРП, используемых для лечения ревматоидного
артрита. Наиболее опасное токсическое действие эти препараты оказывают
на сетчатку глаз, но при рекомендуемых в настоящее время дозах осложнения,
угрожающие зрению, встречаются редко (< 0,2 %). Противомалярийные препараты
способны вызывать желудочно-кишечные расстройства (тошнота и рвота) примерно
у 3 % пациентов, а кожная сыпь наблюдается примерно в 2 % случаев. В настоящее
время в США для своевременного выявления токсического действия препарата
на сетчатку рекомендуется осмотр офтальмологом каждые 6 мес.
13. Как используется D-пеницилламин
для лечения ревматоидного артрита?
|
|
|
|
|
Форма:
Побочные эффекты:
Дозировка: Наблюдение:
|
таблетки
или капсулы по 125 мг и 250 мг. кожная сыпь, протеинурия, гематологические
нарушения (тромбоцитопения). 125-250 мг/сут в течение 2-3 мес с последующим
ступенчатым увеличением дозы до 750-1000 мг/сут до достижения максимального
эффекта, ежемесячно клинический анализ крови с подсчетом количества тромбоцитов,
оценка протеинурии.
|
|
|
|
|
|
Jj-пеницилламин используется
ревматологами редко по причине длительного (до 6 мес) срока, необходимого
для достижения заметного лечебного действия, а также из-за побочных эффектов,
включая (редко) серьезные аутоиммунные расстройства.
14. Какие аутоиммунные
синдромы вызываются D-пеницилламином?
Волчаночноподобный лекарственный
синдром
Синдром Гудпасчера
Миастения (до 3 % пациентов)
Пузырчатка
Полимиозит
Аплазия эритроцитов или апластическая
анемия
15. Как используется сульфасалазин
при лечении ревматоидного артрита?
|
|
|
|
|
Форма:
Побочные эффекты:
Дозировка: Наблюдение:
|
таблетки
по 500 мг (обычные или растворяющиеся в кишечнике), тошнота, рвота, кожная
сыпь, повышение активности печеночных ферментов, нейтропения, азооспермия
(обратимая). 1-3 мг/сут. клинический анализ крови с подсчетом количества
тромбоцитов и печеночные функциональные тесты ежемесячно в течение 3 мес,
затем каждые 3 мес.
|
|
|
|
|
|
Хотя сульфасалазин является
единственным МБАРП, который с самого начала был создан как антиревматическое
средство, в США он формально не одобрен FDA для лечения ревматоидного артрита.
Но поскольку его потенциальная токсичность очень низкая, а эффективность
сравнима с таковой у других МБАРП, использование данного препарата в лечении
ревматоидного артрита в настоящее время неуклонно возрастает. Сульфасалазин
является двухкомпонентным препаратом, состоящим из сульфапиридина (sulfapyridine)
и 5-аминосалициловой кислоты (5-aminosalicylic acid).
16. Когда следует прекратить
назначение МБАРП пациентам, чувствующим себя удовлетворительно?
В большинстве случаев терапию
МБАРП следует продолжать неопределенно долго, в том числе у пациентов,
чувствующих себя удовлетворительно. Спонтанные ремиссии ревматоидного артрита
у больных, требующих лечения МБАРП, не типичны, поэтому для сохранения
эффекта всех существующих сегодня МБАРП требуется поддерживающая терапия.
Прекращение приема большинства этих препаратов может приводить к тяжелым
обострениям.
17. Можно ли для лечения
ревматоидного артрита использовать одновременно два или более МБАРП?
В настоящее время наблюдается
большой энтузиазм по отношению к возможности одновременного использования
двух или более МБАРП для лечения ревматоидного артрита. Он обусловлен результатом
успешного применения такого подхода у пациентов с инфекционными заболеваниями
и раком. В нескольких обзорах сообщалось, что от Уз Д° '/2 пациентов с
ревматоидным артритом можно лечить комбинацией препаратов. К сожалению,
имеется мало данных о результатах такого метода лечения ревматоидного артрита.
В большинстве исследований
не использовались полные терапевтические дозы при комбинировании МБАРП.
Опубликованы данные, что комбинация метотрекса-та, сульфасалазина и гидроксихлорохина
значительно более эффективна при ревма-тоидном артрите, чем изолированная
терапия метотрексатом. В другом исследовании выявлена эффективность комбинации
метотрексата с циклоспорином.
18. Ревматоидный артрит
часто развивается у женщин детородного возраста. Насколько опасны МБАРП
при беременности?
Назначение любого из имеющихся
сегодня МБАРП противопоказано беременным. Наибольший тератогенный эффект
дает метотрексат. К счастью, у большинства пациенток беременность существенно
снижает активность ревматоидного артрита. Если ревматоидный артрит при
беременности требует лечения, можно использовать стероиды, не оказывающие
токсического действия на плод.
19. Какие проявления СКВ
лучше всего поддаются терапии противомалярийными препаратами?
Кожные проявления
Суставная патология
± Общие симптомы (усталость,
лихорадка и др.)
± Серозит
Лечение противомалярийными
препаратами в целом весьма эффективно у пациентов с СКВ. Однако большинство
клиницистов не считают эти препараты пригодны-
ми для острой терапии пациентов
с нефритом, пневмонией, патологией ЦНС или гематологическими заболеваниями
(гемолитические анемии, тромбоцитопении).
20. Каковы другие показания
к использованию противомалярийных препаратов при СКВ?
Сейчас имеются убедительные
данные об исключительной пользе антималярийных препаратов для поддержания
ремиссии и предупреждения обострений СКВ. Пациенты, получающие антималярийные
препараты постоянно, имеют меньшую вероятность обострения, включая вспышки
нефрита и проявления патологии ЦНС. Поэтому почти все больные, для которых
характерна тенденция к вовлечению в патологический процесс внутренних органов,
должны получать терапию противомалярийными препаратами, поскольку у них
высок риск обострения заболевания.
21. Назовите МБАРП, наиболее
часто используемые для лечения тяжелых форм псориатического артрита?
Золото внутримышечно, сульфасалазин,
метотрексат, гидроксихлорохин и азатиоприн. Золото внутримышечно и метотрексат,
используемые в лечении ревматоидного артрита, эффективны и для терапии
псориатического артрита. Метотрексат имеет дополнительное преимущество,
поскольку полезен для лечения кожных повреждений при псориазе. К сожалению,
гепатотоксичность метотрексата при терапии псориатического артрита выше,
чем при ревматоидном артрите. Сульфасалазин также эффективно использовался
для лечения псориатического артрита. Азатиоприн и циклоспо-рин назначались
ограниченно только некоторым пациентам. При применении гидроксихлорохина
описаны выраженные обострения кожной патологии.
22. Как лечить синдром
Рейтера, рефрактерный к терапии МБАРП?
Синдром Рейтера можно лечить
сульфасалазином, метотрексатом или азатиопри-ном. Необходимо соблюдать
осторожность перед началом иммуносупрессивной терапии пациентов с синдромом
Рейтера и убедиться, что они не являются ВИЧ-поло-жительными. Манифестация
СПИД в некоторых случаях провоцируется иммуносупрессивной терапией. Подобная
ситуация также описана для ВИЧ-поло-жительных пациентов с псориазом.
23. При каких ревматических
синдромах показано лечение гидроксихлорохином (плаквенилом)?
Ревматоидный артрит, СКВ,
палиндромный ревматизм, псориатический артрит и, возможно, синдром Шегрена.
Сообщалось об эффективном применении гидроксихлорохина при псориатическом
артрите, но при этом наблюдаются выраженные обострения патологии кожи.
24. Какие ревматические
синдромы лечат сульфасалазином?
Ревматоидный артрит
Синдром Рейтера
Псориатический артрит
Анкилозирующий спондилит
(периферические проявления)
Энтеропатический артрит
25. При каких синдромах
показано лечение золотом?
Ревматоидный артрит Псориатический
артрит
Палиндромный ревматизм Синдром
Рейтера (возможно)
26. Назовите заболевания,
которые обычно лечат D-пеницилламином.
Ревматоидный артрит
Системный склероз (спорно)
Болезнь Вильсона
Цистинурия
Первичный билиарный цирроз
(спорно)
Обширные ретроспективные
исследования выявили уменьшение прогрессиро-вания кожной патологии при
длительной терапии системного склероза. Однако из-за отсутствия проспективных
исследований и наличия потенциальных побочных эффектов некоторые ревматологи
назначают D-пеницилламин при этом заболевании. (Использование D-пеницилламина
для лечения ревматоидного артрита обсуждалось в ответе на вопрос 13.)
Избранная литература
Canadian Hydroxychloroquine
Study Group: A randomized study of the effect of withdrawing hydroxychloroquine
sulfate in systemic lupus erythematosus. N. Engl. J. Med., 324: 150, 1991.
Cash J. M., Klippel J. H.
Second-line drug therapy for rheumatoid arthritis. N. Engl. J. Med., 330:
1368,1994.
Dougados M., van der Linden
S., Leirisalo-Repo M. et al. Sulfasalazine in the treatment of spondyloarthropathy:
A randomized, multicentre, double-blind, placebo-controlled study. Arthritis
Rheum., 38:618-627,1995.
Felson D. Т., Anderson J.
J., Meenan R. F. The comparative efficacy and toxicity of second-line drugs
in rheumatoid arthritis. Arthritis Rheum., 33:1449,1990.
Felson D. Т., Anderson J.
J., Meenan R. F. Use of short-term efficacy/toxicity tradeoffs to select
second-line drugs in rheumatoid arthritis: A metaanalysis of published
clinical trials. Arthritis Rheum., 35:11-17,1992.
Harris E. D. Treatment of
rheumatoid arthritis. In: Kelley W. N., Harris E. D. Jr., Ruddy S., Sledge
C. B. (eds). Textbook of Rheumatology, 4th ed. Philadelphia, W. B. Saunders,
1993, 912-923.
Klippel J. H., Dieppe P.
A. Rheumatology. London, Mosby Europe, 1994.
McCarty D. J., Koopman W.
J. Arthritis and Allied Conditions, 12th ed. Philadelphia, Lea & Febiger,
1993.
O'Dell J., Haire C., Erikson
N. et al. Treatment of rheumatoid arthritis with methotrexate, sulfasalazine,
and hydroxychloroquine, or a combination of these medications. N. Engl.
J. Med., 334:1287-1291,1996.
Situnayake R. D., Grindulis
K. A., McConkey B. Long term treatment of rheumatoid arthritis with sulphasalazine,
gold, or penicillamine: A comparison using life-table methods. Ann. Rheum.
Dis., 46:177,1987.
Williams H. J. Rheumatoid
arthritis. In: Schumacher H. R. (ed.). Primer on the Rheumatic Diseases,
10th ed. Atlanta, Arthritis Foundation, 1993, 86-99.
ГЛАВА 87. ЦИТОСТАТИКИ
И ИММУНОМОДУЛЯТОРЫ
James О'Dell, M.D.
Врач без знания физиологии и химии
практикует допотопную фармацию, поражая болезнь, а нередко и пациента,
сам не понимая, что именно.
Уильям Ослер
1. Каково место метотрексата
среди остальных МБАРП в лечении ревматоидного артрита?
Метотрексат (ревматрекс —
Rheumatrex, иммунекс — Immunex) считается самым эффективным среди МБАРП,
имеющихся в настоящее время для лечения ревматоидного артрита. Это особенно
справедливо, если подсчитать количество пациентов, продолжающих получать
МБАРП через 3-5 лет терапии. 3-5-летний период более показателен в плане
долговременной эффективности препарата по сравнению с большинством опубликованных
данных, касающихся эффективности определенных лекарственных средств через
6-12 мес лечения. Однако при длительной терапии возникает проблема гепатотоксичности
метотрексата. К счастью, у пациентов с ревматоидным артритом цирроз печени,
вызванный метотрексатом, наблюдался чрезвычайно редко. Острая пневмония,
хотя и возникает довольно редко, является существенной проблемой, так как
трудно или даже невозможно предсказать, у кого из пациентов она может развиться.
2. Как метотрексат используется
для лечения ревматоидного артрита?
|
|
|
|
|
Форма:
|
таблетки
по 2,5 мг; флаконы, содержащие 25 мг/мл.
|
|
|
Побочные
эффекты:
|
язвы
ротовой полости, тошнота, депрессия костного моз-
|
|
|
|
га,
цирроз печени, пневмония.
|
|
|
Дозировка:
|
7,5-20
мг внутрь, подкожно или внутримышечно ежене-
|
|
|
|
дельно.
|
|
|
Наблюдение:
|
клинический
анализ крови, АсАТ, АлАТ и альбумин каж-
|
|
|
|
дые
4-6 нед.
|
|
|
Предосторожности:
|
воздержаться
от употребления алкоголя, не применять
|
|
|
|
при
почечной недостаточности, беременности и вместе
|
|
|
с
триметопримом сульфаметоксазолом (бисептолом).
|
|
|
|
|
|
При использовании метотрексата
следует контролировать функцию почек, так как токсичность препарата коррелирует
со степенью почечной недостаточности. У пациентов с почечной недостаточностью
метотрексат необходимо полностью отменить или применять с большой осторожностью.
Кроме того, у пациентов с алкоголизмом в анамнезе, сахарным диабетом, избыточной
массой тела может быть повышен риск гепатотоксического действия препарата,
и в подобных случаях перед началом лечения рекомендуется выполнить биопсию
печени. Некоторые клиницисты считают, что перед назначением метотрексата
необходима рентгенография грудной клетки и, если имеются признаки ревматоидного
поражения легких, метотрексат не применяют (спорное утверждение). Серологические
исследования крови на вирус гепатитов В и С также надо провести до начала
лечения метотрексатом. При положительных результатах анализа выполняется
биопсия печени.
3. Что делать при появлении
менее серьезных побочных эффектов метотрекса-та — язв ротовой полости или
тошноты?
Сейчас имеются убедительные
данные о том, что фолиевая кислота, обычно в дозе 1 мг/сут (иногда до 3
мг/сут), существенно уменьшает эти побочные эффекты метот-рексата без снижения
его эффективности при лечении ревматоидного артрита. Некоторые клиницисты
назначают фолиевую кислоту всем пациентам, которым проводится терапия метотрексатом,
но большинство врачей все же предпочитают использовать фолиевую кислоту
только после появления побочных эффектов.
4. Когда при терапии метотрексатом
необходимо выполнять биопсию печени?
Хотя биопсия печени при терапии
ревматоидного артрита метотрексатом в настоящее время рекомендуется как
рутинное исследование, многие клиницисты назначают ее только по следующим
показаниям:
1. Факторы риска цирроза
(алкоголизм или гепатит в анамнезе).
2. Персистирующее повышение
активности АсАТ, обычно определяемое как подъем более чем на 50 % при измерениях,
сделанных в течение 1 года.
3. Снижение содержания альбуминов
в крови.
4. Псориаз (спорно).
Рекомендация выполнять биопсию
печени у пациентов с псориазом на фоне терапии метотрексатом весьма спорна,
хотя есть данные о том, что метотрексат оказывает более выраженное гепатотоксическое
действие в подобных случаях. Некоторые специалисты назначают проведение
биопсии печени пациентам с псориазом после того, как суммарная доза метотрексата
достигает 1,5-2,5 г.
5. При каких ревматических
заболеваниях общепринято назначение метотрексата?
Ревматоидный артрит Псориатический
артрит Синдром Рейтера Полимиозит/дерматомиозш
СКВ
Системный склероз Гранулематоз
Вегенера Артериит Такаясу
Сейчас изучается эффективность
метотрексата при СКВ, системном склерозе и гранулематозе Вегенера. Многие
врачи также используют метотрексат при гиганто-клеточном артериите.
6. Как используется азатиоприн
(имуран)?
|
|
|
|
|
Форма:
Побочные эффекты:
Дозировка: Наблюдение:
Предосторожности:
|
таблетки
по 50 мг; флаконы, содержащие 100 мг/20 мл раствора, депрессия костного
мозга, тошнота, рвота, кожная сыпь, злокачественные опухоли, гепатотоксичность,
инфекции (Herpes zoster). 50-200 мг/день (1-2,5 мг/кг/сут). клинический
анализ крови и печеночные ферменты ежемесячно, не использовать при беременности,
в сочетании с ингибиторами ангиотензинпревращающего фермента, снижать дозу
азатиоприна на 75 % в комбинации с аллопуринолом.
|
|
|
|
|
|
7. Какие ревматические
болезни обычно лечат азатиоприном?
Ревматоидный артрит
СКВ (особенно люпус-нефрит)
Полимиозит/дерматомиозит
Синдром Рейтера
Многие другие ревматические
заболевания (с целью снижения дозы кортикосте-роидов)
8. Как используется циклофосфамид
при ревматических заболеваниях?
Форма: таблетки по 25 и 50
мг; флаконы по 100, 200, 500 и 1000 мг. Дозировка: внутрь 50-150 мг/сут
(0,7-3 мг/кг/сут);
внутривенно 0,5-1 г/м2
площади поверхности тела 1 раз в месяц. Наблюдение:
При ежедневном приеме: клинический
анализ крови каждые 1-2 нед до стабилизации дозы, затем ежемесячно; контроль
протеинурии — ежемесячно. При ежемесячном в/в введении: клинический анализ
крови и контроль протеинурии перед каждым введением; клинический анализ
крови через 10-14 дней после введения препарата.
9. Какие предосторожности
необходимо соблюдать при использовании цикло-фосфамида у пациентов с ревматоидным
артритом?
• Поддерживать количество
лейкоцитов > 3000/мм3, если их количество падает ниже указанной
величины, необходимо уменьшить дозу препарата на 25 %.
• При внутривенной терапии
многие врачи используют месну (Mesna) в дозе 1 мг на каждый 1 мг циклофосфамида
в 4 приема в течение суток. Для уменьшения риска возникновения геморрагического
цистита проводится обильная гидратация (внутривенно и внутрь).
• Перед внутривенным введением
циклофосфамида следует назначать противо-рвотные средства.
10. При каких ревматических
болезнях показано применение циклофосфамида? Насколько высока его эффективность?
|
|
|
|
|
Гранулематоз
Вегенера СКВ (особенно люпус-нефрит)
|
Ревматоидный
артрит Другие системные васкулиты
|
|
|
|
|
|
Другие ревматические заболевания,
рефрактерные к традиционной терапии Циклофосфамид (цитоксан — Cytoxan)
считается одним из наиболее мощных имму-носупрессивных препаратов, имеющихся
в настоящее время. Он эффективен почти при всех ревматических заболеваниях,
особенно при отсутствии результата от лечения другими, менее сильными и,
как правило, не столь токсичными средствами. Когда целью лечения является
сохранение почечной функции при люпус-нефрите, циклофосфамид дает очень
хороший эффект. Однако из-за его потенциально высокой токсичности данные
об общем снижении смертности не убедительны.
Доказано также, что циклофосфамид
целесообразно назначать при ревматоид-ном артрите, рефрактерном к другим
препаратам. Контролируемых исследований по лечению гранулематоза Вегенера
не проводилось, но этот препарат считается основным при лечении данного
заболевания у пациентов, прогноз у которых в противном случае неблагоприятный.
11. Каковы наиболее серьезные
побочные эффекты циклофосфамида?
• Алопеция.
• Тошнота.
• Инфекции (особенно Herpes
zoster).
• Неходжкинская лимфома.
• Геморрагический цистит.
• Карцинома мочевого пузыря.
• Патология гонад.
Самое неблагоприятное последствие
терапии циклофосфамидом или другими алки-лирующими препаратами — отдаленный
риск развития злокачественных опухолей, особенно неходжкинских лимфом
и рака мочевого пузыря. Этот риск существует, и о нем всегда необходимо
помнить. Кроме того, с увеличением степени иммуносуп-рессии значительно
возрастает вероятность инфекционных осложнений, особенно Herpes zoster.
Циклофосфамид
весьма токсичен для мочевого пузыря, нередко вызывает геморрагический цистит
и может приводить к развитию рака мочевого пузыря. Риск возникновения патологии
мочевого пузыря удается снизить, используя схему внутривенного ежемесячного
введения циклофосфамида.
Степень депрессии костного
мозга зависит от дозы препарата, поэтому ее необходимо постоянно корректировать.
Супрессия функции гонад наблюдается и у мужчин, и у женщин; при необходимости
следует до начала лечения циклофосфамидом сохранить сперму в специальном
банке.
В современных схемах лечения
люпус-нефрита, гранулематоза Вегенера и рев-матоидного артрита используется
ежемесячное внутривенное введение циклофосфамида (вместо традиционного
ежедневного приема внутрь). Эти схемы в большинстве случаев эффективны
и снижают вероятность возникновения некоторых токсических эффектов циклофосфамида,
особенно геморрагического цистита.
12. Какие другие алкилирующие
препараты использовались ранее для лечения ревматических заболеваний?
Азотистый иприт (nitrogen
mustard) и хлорамбуцил (chlorambucil) применялись в терапии некоторых ревматических
болезней (чаще хлорамбуцил). Стандартная доза — 0,1 мг/кг/сут (2-8 мг/сут).
Первоначально хлорамбуцилом лечили глазные и нейропсихические осложнения
болезни Бехчета, а также криоглобулинемию, реф-рактерный полимиозит, люпус-нефрит
и амилоидоз, вторичный по отношению к хроническому воспалительному артриту
(ревматоидный артрит, ювенильный рев-матоидный артрит, анкилозирующий спондилит).
Самыми серьезными осложнениями при лечении этим препаратом являются супрессия
костного мозга, индукция лейкоза и других злокачественных опухолей.
13. Как используют циклоспорин
для лечения ревматических заболеваний?
Форма: капсулы по 25 мг и
100 мг; раствор для приема внутрь, содержащий 100 мг/мл; раствор для внутривенного
введения, содержащий 50 мг/мл.
Дозировка: < 5 мг/кг при
большинстве ревматических болезней. Наблюдение: ежемесячно концентрация
креатинина, величина артериального
давления, содержание циклоспорина
в плазме (спорно). Предосторожности:
одновременное использование
МБАРП может приводить к почечной недостаточности;
дилтиазем увеличивает концентрацию
циклоспорина и вероятность его токсического действия;
циклоспорин отменяют, если
содержание креатинина возрастает на 30 % по сравнению с исходным.
Циклоспорин — сильный иммуномодулятор,
разработанный как противогрибко-вый препарат. Первоначально он использовался
для подавления иммунной системы с целью профилактики отторжения трансплантированных
органов, но после обнаружения сильных иммуносупрессивных свойств его стали
применять для лечения различных ревматических заболеваний, рефрактерных
к другим препаратам.
14. Что такое FK506?
FK506 — это макролид, продуцируемый
грибами. У него иммуносупрессивное действие, сходное с циклоспорином, но
при приеме в дозе, в 10-100 раз более низкой. В будущем он вероятно вытеснит
циклоспорин. И циклоспорин А, и FK506 являются сильными ингибиторами активации
Т-клеток и подавляют транскрипцию генов активации Т-клеток (интерлейкин-2)
посредством блокирования связывания нукле-арного регуляторного фактора
(NF-AT) с его локусами-мишенями в определенных местах этих генов.
15. Какие ревматические синдромы
лечат циклоспорином?
Ревматоидный артрит СКВ
Полимиозит/дерматомиозит
Увеит
Псориатический артрит
Установлено, что циклоспорин
более эффективен в лечении ревматоидного артрита по сравнению с плацебо,
и результаты лечения сходны с таковыми при использовании МБАРП. При других
ревматических болезнях также успешно применяли циклоспорин, но исследований,
подтверждающих его эффективность, не проводилось. Циклоспорин может оказаться
хорошим средством в лечении пациентов с рефрак-терными полимиозитом/дерматомиозитом
и увеитом.
16. Каковы основные токсические
эффекты циклоспорина?
Ухудшение почечной функции
(обычно обратимое)
Инфекционные осложнения
Гипертензия
Гиперпигментация
Гирсутизм, гипертрофия десен
Злокачественные опухоли
Гиперурикемия и подагра
Головные боли
Нефротоксичные эффекты циклоспорина
особенно опасны для пациентов с уже имеющейся патологией почек. Хотелось
бы лечить этим препаратом тех пациентов с СКВ, у которых имеется люпус-нефрит,
но возможность применения ограничена почечной токсичностью. При лечении
ревматоидного артрита нефротоксичность циклоспорина возрастает, поскольку
многие из таких пациентов уже получают МБАРП. Есть данные, что при изолированном
назначении циклоспорина (без МБАРП) по поводу ревматоидного артрита почечная
токсичность выражена меньше. Другим существенным моментом является высокая
стоимость препарата, особенно для пациентов, у которых медицинская страховка
не покрывает затраты на лечение.
17. Насколько серьезен потенциальный
риск развития злокачественных новообразований при использовании метотрексата,
азатиоприна, циклофосфамида и циклоспорина?
Необходимо всегда помнить
о возможности индукции злокачественных новообразований у пациентов, получающих
эти препараты. Многие клиницисты остерегаются
назначать подобную терапию
пациентам с так называемыми доброкачественными опухолями. Следует оценить
соотношение риск/польза, но вряд ли можно возражать против лечения циклофосфамидом,
который является жизнеспасающим препаратом для большинства пациентов с
гранулематозом Вегенера, даже если у небольшого количества этих пациентов
разовьется неходжкинская лимфома.
Риск развития злокачественного
новообразования после иммуносупрессивной терапии максимален при использовании
алкилирующих средств, в частности цикло-фосфамида и хлорамбуцила. Именно
эти два препарата наиболее широко применяются в лечении ревматических заболеваний.
Терапия азатиоприном достоверно увеличивает в 2-5 раз риск индукции злокачественных
новообразований. (У пациентов с трансплантированными органами этот риск
кажется гораздо более существенной проблемой, чем у пациентов с ревматоидным
артритом.) Риск развития злокачественных новообразований, вызванных метотрексатом,
очень низкий, несмотря на имеющиеся описания случаев возникновения липом
на фоне его применения. Цик-лоспорин также может стать причиной их образования.
Некоторые липомы, индуцируемые этими иммуносупрессивными средствами (метотрексат,
циклоспорин), регрессируют после завершения лечения.
18. Использование каких
цитотоксичных препаратов безопасно при беременности?
При беременности противопоказаны
все цитотоксичные и иммуномодулирующие средства. Однако возможно, что их
относительная токсичность различна. Метотрексат и циклофосфамид относятся
к сильным тератогенным средствам и абсолютно противопоказаны за исключением
каких-либо чрезвычайных обстоятельств. Некоторые пациентки с СКВ успешно
принимали азатиоприн, но он также потенциально тератогенен. Циклоспорин
оказывал эмбрио- и фетотоксическое действие в экспериментах на крысах и
кроликах в дозах, в 2-5 раз превосходящих человеческие. Сообщалось об успешном
лечении беременных циклоспорином в обычных дозировках.
19. Какие группы биологических
соединений изучались как возможные средства лечения ревматических заболеваний?
По мере улучшения понимания
патогенеза аутоиммунных ревматических болезней предлагаются различные биологические
агенты для их лечения, особенно для лечения ревматоидного артрита. Их классифицируют
следующим образом.
• Моноклональные антитела:
— против поверхностных молекул
Т-клеток: пан-антигены Т-клеток (AMPATH 1H [anti-CD52]); (anti-CD5); антиген
CD4 (anti-CD4); актива-ционные антигены (anti-TAC [CD25]);
— против цитокинов: TNF-alpha
(anti-TNF-alpha [CA2]);
— против адгезии молекул:
взаимодействие ICAM-1 / LFA-1 (anti-ICAM-1 [CD54]).
• Биопрепараты, воздействующие
на активационные антигены Т-клеток (DAB ИЛ-2).
• Биопрепараты, воздействующие
на молекулы, обеспечивающие взаимодействие Т- и В-клеток:
— взаимодействие CD28/B7
(CTLA-4 Ig);
— ингибиторы цитокинов и
растворимые рецепторы;
— протеины-антагонисты цитокиновыхрецепторов
(IRAP, ИЛ-lRa);
— растворимые рецепторы (ИЛ-IR,
рецептор ФНОР).
• Методы, влияющие на взаимодействие
антиген-ГКТ-РТК:
— орально переносимые (коллаген
типа II при ревматоидном артрите);
— использование пептида РТКВ;
— использование пептида ГКГ
(главный комплекс гистосовместимости).
• Другие:
— антисенсорные олигонуклеотиды;
— вакцинация Т-клетками;
— генная терапия.
20. Как используется у-глобулин
для внутривенного введения в качестве иммуно-модулятора при ревматических
заболеваниях?
Форма: разнообразные формы;
раствор от 3 до 12 %; стоимость
$25-60/г.
Дозировка: 1-2 г/кг, вводимые
за 1-5 дней.
Побочные эффекты: головные
боли (2-20 %), прилив крови, тяжесть в груди, боли в спине/миалгии, лихорадка,
озноб, тошнота, потливость, гипотензия, асептический менингит.
Наблюдение: концентрация
креатинина через 24 ч после инфузии. Предосторожности: анафилактическая
реакция у пациентов с дефицитом IgA,передача инфекционных агентов (редко).
Побочные эффекты у-глобулина
устраняются премедикацией ацетаминофеном и дифенгидрамина гидрохлоридом
(бенадрил) или гидрокортизон натрия сукцина-том (солю-кортеф) или посредством
замедления скорости инфузии. Инфузия начинается с 30 мл/ч и увеличивается
максимально до 250 мл/ч (иногда выше).
21. При каких ревматических
заболеваниях показан у-глобулин IV (для внутривенного введения)? Каков
механизм его действия?
Аутоиммунная тромбоцитопения
Дерматомиозит Болезнь Кавасаки Гранулематоз Вегенера (спорно) Механизмы,
посредством которых иммуноглобулин IV приводит к клиническому улучшению,
обсуждаются. При аутоиммунной тромбоцитопении иммуноглобулин IV блокирует
рецепторы Fc, снижая способность ретикулоэндотелиальной системы удалять
нагруженные антителами тромбоциты. Другие эффекты включают уменьшение продукции
аутоантител и связывания их с тромбоцитами.
При болезни Кавасаки иммуноглобулин
IV действует посредством снижения ад-гезии молекул на эндотелиальных клетках
связывания цитокинов, которые могут вызывать воспаление; уменьшения количества
активированных Т-клеток и связывания поверхностных антигенов стафилококкового
токсина. При гранулематозе Вегенера иммуноглобулин IV снижает концентрацию
аутоантител (АНЦА). Очевидно, существуют и другие механизмы.
22. В каких случаях при
лечении ревматических заболеваний используется плаз-маферез?
Теоретически при плазмаферезе
должны удаляться иммунные комплексы и аутоан-титела, вносящие вклад в патогенез
некоторых ревматических болезней. Имеются хорошие примеры положительного
эффекта плазмафереза в комбинации с а-интер-фероном (или другим антивирусным
агентом) при лечении ассоциированного с гепатитом В узелкового периартериита
и ассоциированной с гепатитами В и С криоглобулинемии. В единичных случаях
плазмаферез давал положительный результат при сочетании с кортикостероидами
и цитотоксичными препаратами при лечении тяжелой люпус-пневмонии, СКВ с
нейропсихическими осложнениями и комой. Плазмаферез обычно используется
в комбинации с кортикостероидами и/или цитостати-ками (для снижения риска
обострения иммунологического заболевания после прекращения фереза). Пока
не получено убедительных доказательств эффективности плазмафереза как рутинного
метода лечения других ревматических заболеваний. Большинство протоколов
лечения с применением обмена плазмы рекомендуют удалять 2-4 л плазмы в
течение 2 ч ежедневно. Замещающим раствором обычно является альбумино-солевой
или какой-либо другой протеинсодержащий раствор. Для снижения риска инфекции
и кровотечения 1-2 пакета (250-500 мл) свежезамороженной плазмы используются
как часть замещающего раствора. В противном случае необходим контроль свертываемости
и содержания иммуноглобулинов. Если у пациента развивается гипогаммаглобулинемия,
то следует ввести у-глобулин внутривенно.
23. Каковы дозировки кортикостероидов
при лечении тяжелых ревматических заболеваний?
Типичным при лечении тяжелых
форм ревматических заболеваний является назначение внутрь преднизона в
дозе 1—2 мг/кг/сут в несколько приемов. Разделение дозы на несколько приемов
необходимо, поскольку действие преднизона на иммунную систему продолжается
обычно только 8—12 ч. Теоретически, преднизон, принимаемый однократно,
не дает такого иммуномодулирующего эффекта, как раздельные дозы. Поэтому
многие клиницисты начинают с раздельных доз в первые 2-4 нед до достижения
контроля над ревматическим процессом и затем переходят на прием 1 раз в
день до начала снижения дозы. Нет общепринятых правил, определяющих необходимость
приема кортикостероидов ежедневно или через день в начале терапии ревматических
заболеваний.
24. Что такое кортикостероидная
пульс-терапия?
Многие клиницисты используют
внутривенную пульс-терапию кортикостероидами в начале лечения тяжелых,
опасных для жизни или функции отдельных органов проявлений ревматических
заболеваний. При этом обычно назначается метилпреднизо-лон в дозе 1 r/сут
в течение 3 дней. Такой режим введения кортикостероида обеспечивает более
выраженный иммуномодулирующий эффект, чем прием больших доз кортикостероида
внутрь (спорно). При кортикостероидной монотерапии пульсовой способ введения,
возможно, не имеет значения для длительного лечения. Однако в комбинации
с цитотоксичным препаратом пульс-терапия кортикостероидом может дать время,
необходимое для развития терапевтического эффекта цитостатика. Эффект пульс-терапии
стероидом обычно сохраняется 3-4 нед. Наиболее часто она использовалась
для лечения тяжелого васкулита, люпус-нефрита и СКВ с нейропсихическими
проявлениями. Побочные явления включают психоз, аритмии и внезапную смерть
(редко). Риск данных осложнений можно уменьшить, снижая скорость инфузии
и поддерживая нормальную концентрацию калия в сыворотке крови.
Избранная литература
Dalakas М. С., Ilia I., DambrosiaJ.
M. et al. A controlled trial of high-dose intravenous immune globulin infusions
as treatment for dermatomyositis. N. Engl. J. Med., 329: 1993-2000, 1993.
Fauci A., Young K. Jr. Immunoregulatory
agents. In: Kelley W. N., Harris E. D. Jr., Ruddy S., Sledge C. B. (eds).
Textbook of Rheumatology, 4th ed. Philadelphia, W. B. Saunders 1993 797-821.
Felson D. Т., Anderson J.
J., Meenan R. F. The comparative efficacy and toxicity of second-line drugs
in rheumatoid arthritis. Arthritis Rheum., 33:1449,1990.
Klassen L. W., Calabrese
L. H., Laxer R. M. Intravenous immunoglobulin in rheumatic disease. Rheum.
Dis. Clin. North Am., 22:155-174,1996.
Klippel J. H., Dieppe P.
A. (eds). Rheumatology. London, Mosby Europe, 1994,14.1-4.
Kremer J. M., Alarcon G.
S., Lightfoot R. W. Jr. et al. Methotrexate for rheumatoid arthritis: Suggested
guidelines for monitoring liver toxicity. Arthritis Rheum., 37: 316,1994.
Landewe R. B. M., Goei H.
S., van Rijthoven A. W. A. M. et al. A randomized, double-blind, 24-week
controlled study of low dose cyclosporine versus chloroquine for early
rheumatoid arthritis. Arthritis Rheum., 37: 637,1994.
Lewis E. J., Hunsicker L.
G., Lan S. P. et al. A controlled trial of plasmapheresis therapy in severe
lupus nephritis. N. Engl. J. Med., 326:1373-1379,1992.
McCarty D. J., Koopman W.
J. (eds). Arthritis and Allied Conditions, 12 ed. Philadelphia, Lea &
Febiger, 1993,645-664.
Morgan S. L, Baggott J. E.,
Vaughn W. H. et al. The effect of folic acid supplementation on the toxicity
of low-dose methotrexate in patients with rheumatoid arthritis. Arthritis
Rheum., 33:9,1990.
Ratko T. A., Bumett D. A.,
Fouike G. E. etal. Recommendations for off-label use of intravenously administered
immunoglobulin preparations. JAM A, 273:1865-1870,1995.
Schumacher H. R. (ed.). Primer
on the Rheumatic Diseases, 10th ed. Atlanta, Arthritis Foundation, 1993.
Situnayake R. D., Grindulis
K. A., McConkey B. Long-term treatment of rheumatoid arthritis with sulphasalazine,
gold, or penicillamine: A comparison using life-table methods. Ann. Rheum.
Dis., 46:177,1987.
Strand V., Keystone E., Breedveld
F. Biologic agents for treatment of rheumatoid arthritis. Rheum. Dis. Clin.
North Am., 22:117-132,1996.
Tugwell P., Pincus Т., Yocum
D. et al. Combination therapy with cyclosporine and methotrexate in severe
rheumatoid arthritis. N. Engl. J. Med., 333:137-141,1995.
ГЛАВА 88. ГИПОУРИКЕМИЧЕСКИЕ
СРЕДСТВА И КОЛХИЦИН
David R. Finger, M.D.
1. Каковы цели лечения
подагры?
Основная цель — безопасное
и быстрое купирование острых атак (устранение боли и восстановление функции
суставов). Это обычно достигается с помощью НПВС или колхицина. Когда данная
цель достигнута, следующими задачами становятся профилактика рецидивов,
прогрессирования деструктивной артропатии, образования то-фусов и нефролитиаза.
2. Что такое колхицин?
Колхицин — это алкалоид,
получаемый из растения Colchicum autumnale. Он использовался для
лечения острой подагры в течение почти двух веков и для устранения суставных
болей с VI в. Долгое время считалось, что купирование острого артрита приемом
колхицина является диагностическим признаком подагры, хотя некоторые другие
воспалительные артропатии (псевдоподагра, острый саркоидоз) также хорошо
поддаются терапии этим средством. Еще более столетия назад Гарро (Garrod)
утверждал, что "колхицин обладает такой же специфичностью для контроля
воспалительного процесса при подагре, как и кора хинного дерева при интермиттирующей
лихорадке.... Мы иногда можем дифференцировать подагру от любого другого
вида воспаления, наблюдая действие колхицина в динамике."
3. В каких случаях показана
терапия колхицином? Какие дозы препарата при этом используются?
Колхицин можно использовать
при острых атаках подагры и в качестве профилактического средства против
рецидивов, особенно если проводится гипоурикемическая терапия. Колхицин
выпускается в форме таблеток по 0,5 мг и 0,6 мг и раствора для парентерального
введения, содержащего 0,5 мг/мл.
Средняя профилактическая
доза составляет 0,5 мг два раза в сутки. При длительном применении такая
доза или полностью предупреждает обострения, или существенно снижает их
частоту более чем у 90 % пациентов. Профилактические дозы колхицина обычно
не вызывают желудочно-кишечных побочных эффектов, и проти-ворецидивную
терапию необходимо проводить в течение нескольких месяцев на фоне отсутствия
симптомов подагры.
При обострениях наиболее
эффективно назначение колхицина в первые несколько часов. Доза при приеме
внутрь может достигать 0,5 мг/ч до улучшения состояния или появления побочного
действия, но не более 12 таблеток (за исключением пожилых людей и пациентов
с почечной недостаточностью, которые должны получать меньшее количество
таблеток). Боль обычно купируется в течение 24 ч у 90 % пациентов, но при
таком режиме приема препарата во многих случаях возникает диарея.
4. Каковы противопоказания
для парентерального введения колхицина?
При парентеральной терапии
вероятность возникновения желудочно-кишечных побочных эффектов по сравнению
с приемом внутрь меньше, но другие токсические эффекты значительно более
выражены. Во многих странах, включая Великобританию и США, парентеральная
форма колхицина не используется, так как описаны летальные случаи в результате
супрессии костного мозга. По этой причине парентеральное введение препарата,
по-видимому, допустимо только тогда, когда пациент не способен принимать
его внутрь. Колхицин для внутривенного введения, вероятно, будет снят с
производства вследствие его высокой токсичности.
Противопоказания к внутривенному
введению колхицина
|
|
|
|
|
АБСОЛЮТНЫЕ
|
ОТНОСИТЕЛЬНЫЕ
|
|
|
Предсуществующая
депрессия костного мозга Клиренс креатинина < 10 мл/мин Внепеченочная
билиарная обструкция Сепсис
|
Предшествующее
применение колхицина Печеночная или почечная недостаточность Старческий
возраст Локализованная инфекция
|
|
|
|
|
|
5. Что еще надо знать
о дозировке и об особенностях лечения колхицином, вводимым парентерально?
• Не более 2 мг колхицина
на одно введение, а суточная доза не должна превышать 4 мг. У пациентов
с почечной или печеночной недостаточностью и у людей пожилого возраста
дозу следует уменьшить на 50 %. Нельзя использовать колхицин при сочетании
почечной и печеночной дисфункции.
• Колхицин может вызывать
локальный некроз тканей, поэтому он должен вводиться через отдельную внутривенную
систему для уменьшения риска экстра-вазального попадания препарата.
• Не следует дополнительно
назначать колхицин ранее чем через 7 дней после его парентерального введения.
6. Что известно о механизмах
действия и фармакокинетике колхицина?
Колхицин не влияет на концентрацию
уратов в сыворотке крови и на их метаболизм. Это противовоспалительный
препарат, прежде всего он необратимо связывается с димерами тубулина, предупреждая
их превращение в микротубулы (что препятствует хемотаксису нейтрофилов).
Кроме того, колхицин тормозит мембранозависи-мые функции нейтрофилов (фагоцитоз)
и ингибирует фосфолипазу А2. Это приводит к снижению концентрации
воспалительных простагландинов и лейкотриенов. Колхицин не связывается
с белками плазмы и обладает высокой растворимостью в липидах, легко проникая
во все ткани. Период полувыведения составляет 4 ч при приеме внутрь и менее
1 ч при парентеральном введении. Колхицин можно обнаружить в нейтрофилах
в срок до 10 сут после однократного введения. Он метаболизи-руется в печени
и экскретируется преимущественно с желчью, 20 % препарата выводится в неизмененном
виде с мочой.
7. Опишите различные проявлениях
токсичности колхицина.
Большинство побочных эффектов
колхицина дозозависимы и чаще наблюдаются при внутривенном введении, чем
при приеме внутрь (за исключением желудочно-кишечных осложнений). Антидотов
к колхицину не существует, а гемодиализ при передозировке неэффективен.
Потенциальные побочные эффекты включают:
• желудочно-кишечные осложнения
(диарея, тошнота, рвота, редко — синдром мальабсорбции и геморрагический
гастроэнтерит); обычно при приеме внутрь;
• супрессия костного мозга
(тромбоцитопения, лейкопения);
• нейромиопатия (увеличение
активности креатинкиназы, слабость, периферическая нейропатия, лизосомальные
вакуоли при биопсии); обычно наблюдается при почечной недостаточности на
фоне хронической терапии;
• алопеция;
• шок, диссеминированное
внутрисосудистое свертывание (парентеральная терапия);
• дисфункция ЦНС;
• целлюлит или тромбофлебит
(парентеральная терапия).
8. Какие имеются антигиперурикемические
препараты?
К антигиперурикемическим
препаратам относятся урикозурические средства (про-бенецид и сульфинпиразон),
снижающие концентрацию уратов в сыворотке крови посредством увеличения
почечной экскреции мочевой кислоты, а также ингибиторы ксантиноксидазы
(аллопуринол), подавляющие синтез мочевой кислоты путем ингибирования ксантиноксидазы
— фермента, участвующего в конечной стадии продукции мочевой кислоты. Эти
препараты следует назначать только после полного купирования обострения
подагры.
Риск рецидива после начала
антигиперурикемической терапии можно уменьшить, ступенчато повышая дозы
препарата и проводя профилактическое лечение колхицином или НПВС. Решение
об использовании антигиперурикемических средств является обычно не столь
срочным, поэтому следует начинать эту терапию только тогда, когда она действительно
показана. У некоторых пациентов с выраженными тофусами урикозурические
препараты можно безопасно применять в сочетании с аллопуринолом.
9. Какие пациенты с подагрой
являются кандидатами на проведение урикозури-ческой терапии?
• Гиперурикемия в результате
снижения экскреции мочевой кислоты (< 800 мг мочевой кислоты в моче,
собранной за 24 ч при обычной диете).
• Возраст < 60 лет.
• Клиренс креатинина <
50 мл/мин.
• Отсутствие нефролитиаза
в анамнезе.
10. Назовите урикозурические
препараты и опишите механизм их действия.
Многие препараты обладают
урикозурическими свойствами, включая аспирин и са-лицилаты в высоких дозах,
но двумя наиболее распространенными в клинической практике средствами являются
пробенецид и сульфинпиразон. Урикозурические препараты относятся к слабым
органическим кислотам, подобно мочевой кислоте, и увеличивают ее экскрецию
с мочой посредством конкурентного ингибирования ка-нальцевой реабсорбции
уратов. Эти препараты эффективно снижают содержание мочевой кислоты в сыворотке
крови до < 6,7 мг/дл у 75 % пациентов. Следует избегать одновременного
использования низких доз аспирина или салицилатов, так как они ингибируют
секрецию уратов. Урикозурические средства работают лучше при щелочной реакции
мочи и хорошем суточном диурезе (> 1500 мл), который минимизирует риск
мочекислой нефропатии и нефролитиаза.
11. Как дозируются пробенецид
и сульфинпиразон? Чем отличаются эти препараты?
Сульфинпиразон — аналог метаболита
фенилбутазона, но он не обладает противовоспалительными свойствами. Этот
препарат на 98 % связывается с белками плазмы и имеет период полувыведения
1-3 ч. 20-45 % препарата выводится в неизмененной форме с мочой, остальная
часть — в виде урикозурического метаболита. В отличие от пробенецида, сульфинпиразон
имеет антитромбоцитарную активность, поскольку ингибирует синтез тромбоксана.
Препарат выпускается в таблетках по 100 и 200 мг. В начале лечения назначается
по 50 мг 2 раза в сутки с дальнейшим ступенчатым увеличением до поддерживающего
уровня 300-400 мг/сут в 3-4 приема. Сульфинпиразон в 3-6 раз более эффективен,
чем пробенецид у пациентов с почечной недостаточностью.
Пробенецид оказывает более
длительное действие (6-12 ч) и сильнее метаболи-зируется по сравнению с
сульфинпиразоном. Аллопуринол увеличивает период полувыведения пробенецида,
а пробенецид увеличивает период полувыведения пенициллина, ампициллина,
дапсона, индометацина и сульфинпиразона, снижая их почечную экскрецию,
и замедляет метаболизм гепарина. Пробенецид выпускается в таблетках по
500 мг. Прием препарата начинается с 250 мг 2 раза в день, в дальнейшем
доза может быть ступенчато увеличена до 3 г/сут (средняя доза 1 г/сут)
в 2-3 приема.
12. Каковы побочные эффекты
урикозурической терапии?
Урикозурические препараты
обычно хорошо переносят более чем 90 % пациентов, при этом серьезные осложнения
наблюдаются редко.
|
|
|
|
|
Предотвращаемые
Обострения подагры Уратная
нефропатия Уратный нефролитиаз Относительно частые
Гастроинтестинальные симптомы
(10 %) Дерматит (5 %) Головная боль Лекарственная лихорадка
|
Редкие
Гемолитическая анемия Апластическая
анемия Нефротический синдром Гепатонекроз Анафилаксия
|
|
|
|
|
|
13. Назовите ингибиторы
синтеза мочевой кислоты.
Аллопуринол, аналог гипоксантина,
является наиболее часто используемым ингибитором синтеза мочевой кислоты.
Оксипуринол, аналог ксантина и основной метаболит аллопуринола, плохо всасывается
в желудочно-кишечном тракте. В США этот препарат не применяется, но в Европе
назначается пациентам, у которых отмечены аллергические реакции на аллопуринол.
14. Каковы показания к
использованию аллопуринола?
Показания к назначению аллопуринола
при подагре:
1. Гиперпродукция уратов
(мочевая кислота > 800 мг в моче, собранной за 24 ч, при обычной диете).
2. Нефролитиаз.
3. Почечная недостаточность
(клиренс креатинина < 50 мл/мин).
4. Тофусы (может потребоваться
6—12 мес для их рассасывания).
5. Неэффективность или непереносимость
урикозурических препаратов. Другие показания к назначению аллопуринола:
1. Гиперурикемия с нефролитиазом
любого типа.
2. Профилактика синдрома
лизиса опухоли.
3. Дефицит гипоксантинфосфорибозилтрансферазы
(синдром Леша-Найхена [Lesch-Nyhan]).
4. Гиперурикемия вследствие
миелопролиферативных нарушений.
5. Концентрация уратов в
сыворотке крови > 12,0 мг/дл или количество мочевой кислоты в суточной
моче > 1100 мг.
15. Опишите механизм действия
и фармакокинетические свойства аллопуринола.
Аллопуринол снижает концентрацию
уратов в крови и в моче путем ингибирования ксантиноксидазы, что приводит
к увеличению содержания предшественников ксантина и гипоксантина. Сам аллопуринол
метаболизируется ксантиноксидазой до активного метаболита оксипуринола,
концентрацию которого можно измерить для оценки эффекта. Препараты, метаболизм
которых зависит от этого фермента, например 6-меркаптопурин и азатиоприн,
при введении с аллопуринолом требуют снижения дозы на 50-75 %. Аллопуринол
хорошо абсорбируется в желудочно-кишечном тракте и имеет период полувыведения
40 мин; а оксипуринол всасывается плохо, но имеет гораздо более длительный
период полувыведения (14-28 ч). При почечной недостаточности дозу аллопуринола
необходимо уменьшить. Максимальный анти-гиперурикемический эффект развивается
на 4-14-е сутки лечения.
16. Каковы дозировки аллопуринола?
Аллопуринол выпускается в
таблетках по 100 мг и 300 мг, обычно принимаемых 1 раз в день до снижения
концентрации уратов в сыворотке < 6,7 мг/дл. Средняя доза для достижения
такого эффекта составляет 300 мг/сут, но может быть увеличена до 600 мг/сут.
Если для снижения содержания мочевой кислоты до адекватного уровня требуется
доза аллопуринола > 300 мг/сут, следует выявить другие корригируемые факторы,
которые могут приводить к гиперурикемии. Дозу необходимо снижать при почечной
недостаточности, так как оксипуринол выводится почками. Доза уменьшается
до 200 мг/сут, если скорость клубочковой фильтрации не превышает 60 мл/мин,
и до 100 мг/сут, когда она снижается до 20 мл/мин.
17. Назовите основные
токсические эффекты аллопуринола.
Общая частота встречаемости
побочных эффектов около 20 %, но только 5 % всех пациентов вынуждены прекратить
прием препарата вследствие его токсичности. Десенсибилизация при приеме
внутрь низких доз была эффективна у некоторых пациентов с менее серьезными
реакциями на аллопуринол. Частые (и редко серьезные) осложнения
Острый подагрический артрит
Макуло-папулезная эритема
(3-10 %; риск в 3 раза выше в сочетании с ампи-циллином)
Тошнота
Диарея
Аномальная активность печеночных
ферментов
Головная боль Нечастые
(потенциально опасные) осложнения
Токсический эпидермальный
некролиз, шелушащийся дерматит
Синдром гиперчувствительности
к аллопуринолу
Супрессия костного мозга
Гепатит
Васкулит
Периферическая нейропатия
Почечная патология (интерстициальный
нефрит)
Оксипуриноловый или ксантиновый
нефролитиаз
Катаракта
Саркоидозоподобная реакция
Алопеция
Лимфаденопатия
Лихорадка
18. В чем заключается
синдром гиперчувствительности к аллопуринолу?
Синдром гиперчувствительности
к аллопуринолу возникает примерно у 10 % пациентов с аллопуриноловой сыпью.
Обычно у них имеется почечная недостаточность (75 %) и проводится диуретическая
терапия (50 %). Этот синдром, как правило, развивается через 2-4 нед. после
начала лечения (смертность достигает 25 %). Клинические проявления включают
кожную сыпь, лихорадку, эозинофилию, гепатонекроз, лейкоцитоз и ухудшение
почечной функции у большинства пациентов. Для лечения эффективны высокие
дозы преднизона и проведение гемодиализа (для удаления ок-сипуринола).
19. Укажите места действия
препаратов, используемых для лечения острой подагры и снижения концентрации
уратов в сыворотке крови.
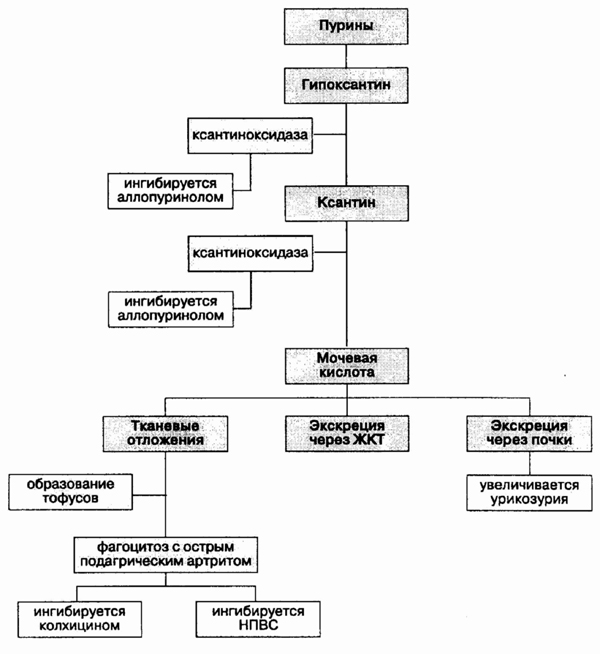
Препараты, используемые для лечения
подагры, и места их действия (По: Klippel J. H., Dieppe P. A. (eds). Rheumatology.
London, Mosby, 1994.)
Избранная литература
Emmerson В. Т. Antihyperuricemics.
In: Klippel J. H., Dieppe P. A. (eds). Rheumatology, London, Mosby, 1994,
8:15.1-15.6.
Fam A. G., Lewtas J., Stein
J., Paton T. W. Desensitization to allopurinol in patients with gout and
cutaneous reactions. Am. J. Med., 93: 299-302,1992.
Fox I. H. Antihyperuricemic
drugs. In: Kelly W. N.. Harris E. D., Ruddy S., Sledge С. В. (eds). Textbook
of Rheumatology, 4th ed. Philadelphia, W. B. Saunders, 1993,822-831.
Hande K. R., Noone R. M.,
Stone W. J. Severe allopurinol toxicity: Description and guidelines for
prevention in patients with renal insufficiency. Am. J. Med., 76: 47-56,1984.
Hardin J. G., Longenecker
G. L. Drugs used in the treatment of gout and pseudogout. In: Hardin J.
G., Longenecker G. L. (eds). Handbook of Drug Therapy in Rheumatic Disease.
Boston, Little, Brown & Co, 1992,146-174.
Hartung E. F. History of
the use of colchicine and related medicaments in gout. Ann. Rheum. Dis.,
13:190-200,1954.
Roberts W. N., Liang M. H.,
Stern S. H. Colchicine in acute gout: Reassessment of risks and benefits.
JAMA, 257:1920-1922,1987.
Singer J. Z., Wallace S.
L. The allopurinol hypersensitivity syndrome: Unnecessary morbidity and
mortality. Arthritis Rheum., 29: 82-87,1986.
Terkeltaub R. A. Pathogenesis
and treatment of crystal-induced inflammation. In: McCarty D. J., Koopman
W. J. (eds). Arthritis and Allied Conditions, 12th ed. Philadelphia, Lea
& Febiger, 1993,1819-1833.
Wallace S. L., Bernstein
D., Diamond H. Diagnostic value of the colchicine therapeutic trial. JAMA,
199:525-528,1967.
Wallace S. L., Singer J.
Z. Systemic toxicity associated with the intravenous administration of
colchicine - Guidelines for use. J. Rheumatol., 15: 495-499, 1988.
Wortmann R. L. Management
of hyperuricemia. In: McCarty D. J., Koopman W. J. (eds). Arthritis and
Allied Conditions, 12th ed. Philadelphia, Lea & Febiger, 1993,1807-1818.
ГЛАВА 89.
ПРЕПАРАТЫ, УКРЕПЛЯЮЩИЕ КОСТИ
Michael Т. McDermott, M.D.
i. Что такое костная
перестройка?
Это процесс, в ходе которого
остеокласты резорбируют старую костную ткань, а остеобласты секретируют
остеоид, который затем минерализируется кристаллами гидроксиапатита, формируя
новую кость. Костная перестройка обеспечивает удаление слабой старой костной
ткани и замещение ее крепкой новой костью в тех отделах скелета, которые
подвергаются наибольшему механическому напряжению.
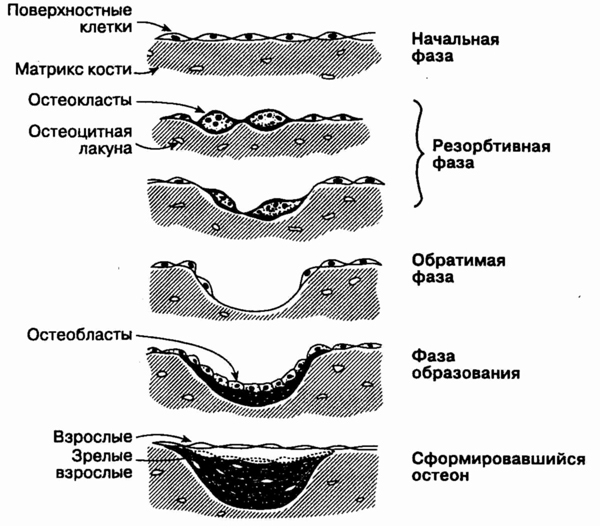
Перестройка кости. Остеокласты резервируют
старую костную ткань, оставляя пустую резорбционную полость. Затем остеобласты
заполняют эту полость, секретируя остеоид, который минерализируется кальцием
и фосфатом из внеклеточной жидкости, формируя новую кость. (Из: Peck W.
A. (ed.). Bone and Mineral Research Annual 2, New York, Elsevier, 1984.)
2. Когда происходит костная
резорбция?
Костная резорбция наблюдается
при условии участия стволовых гемопоэтических клеток в формировании новых
остеокластов. Эти многоядерные гигантские клетки присоединяются к поверхности
кости своей рифленой мембраной и секретируют кислоту и ферменты, разрушающие
кость. Резорбция кости остеокластами стимулируется, прежде всего, циркулирующим
паратиреоидным гормоном и локально продуцируемыми цитокинами (интерлейкин-6).
Процесс ингибируется кальцитонином, половыми стероидами и другими цитокинами.
3. Как регулируется образование
костной ткани?
Образование костной ткани
происходит благодаря тому, что остеобласты секретируют остеоид, который
затем минерализуется путем депонирования кристаллов гидро-ксиапатита (кальция
фосфата). Образование кости стимулируется паратиреоидным гормоном, половыми
стероидами, инсулиноподобным фактором роста 1 и локально продуцируемыми
цитокинами.
4. Чем различаются высокооборотный
и низкооборотный остеопороз? Высокооборотный остеопороз проявляется
быстрым исчезновением костной ткани вследствие большой скорости костной
резорбции в сочетании с нормальной или умеренно повышенной остеоформацией.
Эта форма обычно наблюдается в первые годы после менопаузы и ответственна
менее чем за 30 % всех случаев остеопороза. Мочевал экскреция поперечных
цепей пиридинолина, маркера резорбции, и концентрация остеокальцина сыворотки,
отражающего процесс остеоформации, в нормальных пределах или повышены.
Лечение осуществляют антирезорбтивными средствами. Низкооборотный остеопороз
проявляется
низкой скоростью костной резорбции и еще более низкой скоростью образования
новой костной ткани. Эта форма обычно наблюдается у пациенток через более
чем 10 лет после менопаузы. Имеется тенденция к снижению мочевой экскреции
поперечных цепей пиридинолина и концентрации остеокальцина. Лечение проводится
средствами, стимулирующими остеоформацию.
5. Какие терапевтические
средства эффективно воздействуют на костное ремо-делирование?
Действие средств на костную резорбцию
|
|
|
|
|
ИНГИБИРУЮЩИЕ
РЕЗОРБЦИЮ
|
СТИМУЛИРУЮЩИЕ
ОБРАЗОВАНИЕ
|
|
|
Кальций Витамин
D Эстроген Кальцитонин Бисфосфонаты
|
Ионы фтора
Кальцитриол Андрогены Гормон роста Паратиреоидный гормон
|
|
|
|
|
|
6. Как антирезорбтивные
и стимулирующие остеоформацию средства действуют на костную массу?
Стимулирующие остеоформацию
средства обычно вызывают почти линейное возрастание костной массы у большинства
пациентов. Антирезорбтивные препараты, как правило, увеличивают костную
массу на 0-4 % при низкооборотном остеопорозе и на 5-20 % при высокооборотном
остеопорозе в первые 6-18 мес лечения, в дальнейшем костная масса стабилизируется
на постоянном уровне.
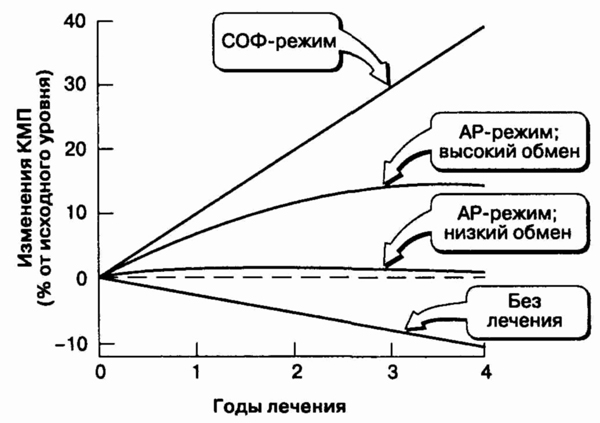
Изменение костной минеральной плотности
(КМП) в результате терапевтических воздействий. Стимулирующие остеоформацию
(СОФ) препараты вызывают линейное возрастание КМП. Антирезорбтивные (АР)
средства транзиторно увеличивают КМП на 5-20 % при высокооборотном остеопорозе
и на 0-4 % при низкооборотном, после чего они поддерживают КМП на стабильном
уровне. (Из: Riggs В. L, Melton III L J. The prevention and treatment of
osteoporosis. N. Engl. J. Med., 327:620-627, 1992.)
7. Как антирезорбтивные
средства увеличивают костную массу?
Эти препараты значительно
уменьшают костную резорбцию, не влияя на остеофор-мацию. В результате,
по крайней мере временно, остеоформация превосходит резорбцию, и костная
масса увеличивается. Этот феномен называют временным костным ремоделированием.
Через 6-18 мес остеоформация ступенчато снижается до уровня резорбции,
и дальнейшего увеличения костной массы не происходит.
8. Почему антирезорбтивные
препараты являются средствами первого выбора для профилактики и лечения
остеопороза?
Антирезорбтивные препараты
обычно безопасны, эффективны и не слишком дорогостоящие. Стимулирующие
остеоформацию препараты в целом имеют меньшую эффективность, более существенные
побочные эффекты и/или высокую стоимость. Кроме того, большинство из них
все еще находятся на стадии исследований.
9. Какие пищевые продукты
являются лучшими источниками кальция?
Молочные продукты и обогащенные
кальцием соки цитрусовых. Необходимо выяснить у пациентов, потребляют ли
они эти продукты. Если с пищей в организм поступает недостаточно кальция,
следует использовать кальциевые добавки.
Пищевые источники кальция
|
|
|
|
|
ИСТОЧНИК
|
ПРИМЕРНОЕ
СОДЕРЖАНИЕ КАЛЬЦИЯ
|
|
|
Молоко Сыр
Йогурт Цитрусовый сок с кальцием
|
300 мг/чашку
200 мг/унцию1 350 мг/чашку 300 мг/чашку
|
|
|
|
|
|
1 Унция = 28,35 г.
10. Какова рекомендуемая
норма потребления кальция внутрь?
Для мужчин и женщин до менопаузы
— 1000 мг в сутки. Для женщин после менопаузы и пациентов с остеопорозом
— 1500 мг в сутки.
11. Какова роль терапии
витамином D?
Витамин D способствует абсорбции
кальция в кишечнике. Рекомендуемая суточная доза витамина D составляет
400 ЕД. Введение 400-800 ЕД в сутки обеспечивает оптимальную абсорбцию
кальция и уменьшает редукцию костной ткани, особенно в зимние месяцы, когда
существенно снижается воздействие солнечного света на кожу. Кальцитриол
в физиологических дозах 0,25-1,0 мкг/сут имеет сходный эффект, но он значительно
дороже.
12. Какова роль заместительной
терапии эстрогенами при остеопорозе?
Эстрогены ингибируют костную
резорбцию. Они умеренно увеличивают костную массу и снижают риск переломов
позвоночника, бедра и костей запястья. Эстрогены наиболее эффективны для
профилактики остеопороза, развивающегося после менопаузы. Показано, что
эстрогены полезны также для лечения уже возникшего остеопороза. Нерожавшие
женщины также должны получать прогестерон для профилактики эстрогениндуцируемой
гиперплазии эндометрия и карциномы матки. Основным недостатком циклической
гормональной заместительной терапии является подавление менструаций, которое
существенно уменьшается или устраняется при непрерывном (ежедневном) режиме
лечения.
Обычные режимы заместительной терапии
эстрогенами
13. Насколько эффективен
кальцитонин при лечении остеопороза?
Кальцитонин напрямую ингибирует
остеокласты. При этом наблюдается небольшой прирост костной массы, подобно
таковому при действии эстрогенов. Кальцитонин также значительно уменьшает
боли у 80 % пациентов с переломами, это происходит за счет высвобождения
опиоидов в центральной нервной системе. Кальцитонин чаще всего назначают
в виде подкожных инъекций в дозе от 50 ЕД 3 раза в неделю до 100 ЕД/сут.
Имеется также носовой аэрозоль кальцитонина (миакальцин — Miacalcin, 200
ЕД/доза). Рекомендуется попеременное введение одной дозы в одну из ноздрей
ежедневно.
14. Эффективно ли лечение
бисфосфонатами при остеопорозе?
Бисфосфонаты умеренно увеличивают
костную массу и снижают частоту возникновения переломов. Пока не ясно,
эффективны ли эти препараты при длительном применении, но предварительные
результаты положительные. Этидронат (Etidronate) назначается циклами: внутрь
в дозе 200 мг 2 раза в день в первые 14 сут каждого 90-дневного цикла.
Кальциевые добавки, нарушающие абсорбцию бисфосфонатов в кишечнике, исключаются
в эти 14 дней, но должны применяться в последующие 76 дней цикла. Алендронат
(Alendronate), новое и более сильное средство, назначается по 10 мг внутрь
каждое утро, при этом кальциевые добавки употребляются на ночь.
15. Какова роль физических
упражнений при лечении остеопороза?
Физические упражнения стимулируют
остеоформацию и ингибируют резорбцию. Они способствуют снижению вероятности
и тяжести падений за счет улучшения мышечной силы и координации движений.
Полезны упражнения как с дополнительной нагрузкой, так и без нее.
16. Каково действие фтористого
натрия на скелет?
Фтористый натрий стимулирует
остеоформацию посредством неясных пока механизмов. У пациентов с остеопорозом
препарат в дозе 50-75 мг/сут внутрь вызывает прогрессивное увеличение костной
массы. Однако гистологически кость дезорганизована, а клинически не наблюдается
снижения вероятности переломов, что свидетельствует о структурной или механической
аномалии новой костной ткани.
17. Наблюдаются ли побочные
эффекты при лечении фтористым натрием?
Симптомы гастрита развиваются
у 20-30 % пациентов при приеме 50 мг препарата в день и у 50 % пациентов
— при дозе 75 мг/сут.
|
|
|
|
|
|
ПРЕПАРАТ
|
ДОЗА
|
РЕЖИМ
|
|
|
ЦИКЛИЧЕСКИЙ
ЕЖЕДНЕВНЫЙ
|
|
|
Заменители
эстрогена
|
|
|
|
|
Конъюгированные
эстрогены (премарин — Premarin) Этинил эстрадиол Эстрогеновый пластырь
(эстрадерм — Estraderm)
|
0,625-1,
25мг
50мг 0,05-0,1 мг
|
1 -25-й дни
цикла Ежедневно
1 -25-й дни цикла Ежедневно Каждый
3-й день, Каждый 3-й день 1-25-й дни цикла
|
|
|
Заменители
прогестерона
Медроксипрогестерон — Medroxypro-gesterone
(провера — Provera)
|
10мг 2,5мг
|
1 3-25-й
дни цикла Ежедневно
|
|
|
|
|
|
|
Синдром болезненности
нижних конечностей, заключающийся в острых болях, слабости и дрожании
ног, наблюдается у многих пациентов. Эти нарушения, возможно, обусловлены
быстрой заменой старой костной ткани на новую. Для устранения синдрома
необходимы покой и аналгезия, тогда исчезновение симптоматики происходит
через 6-8 нед после прекращения приема препарата. При возобновлении терапии
фтористым натрием рецидива синдрома, как правило, не наблюдается.
18. Должны ли мы отказаться
от использования фтористого натрия в качестве терапевтического средства
при остеопорозе?
Совсем нет. Большинство специалистов
считают, что просто еще не найден оптимальный способ использования данного
препарата. Результаты недавних исследований показали, что интермиттирующая
терапия пролонгированной формой фтористого натрия увеличивает костную массу
и уменьшает вероятность новых переломов при низкой частоте побочных эффектов.
19. Как терапия кальцитриолом
(1,25-дигидроксивитамин D) действует на целостность скелета?
Стимулируя кишечную абсорбцию
кальция, физиологические дозы кальцитриола (0,5 мкг/сут) способствуют положительному
балансу кальция и снижают вероятность переломов. Высокие дозы кальцитриола
(2 мкг/сут) дополнительно стимулируют остеоформацию, приводя к увеличению
плотности кости. Высокие дозы препарата необходимо сочетать с низкой или
умеренной кальциевой диетой во избежание возникновения токсических эффектов.
20. Как своевременно выявить
токсическое действие кальцитриола?
Витамин D и его аналоги являются
жирорастворимыми веществами и поэтому могут накапливаться в организме до
достижения токсического уровня. Токсический эффект витамина D проявляется
сначала гиперкальцийурией, предрасполагающей к нефролитиазу и, иногда,
к гиперкальциемии. Пациентов, получающих сверхфизиологические дозы витамина
D или кальцитриола, необходимо обследовать каждые 6 мес с измерением суточной
мочевой экскреции кальция и концентрации кальция в сыворотке крови.
21. Увеличивают ли андрогены
костную массу?
Андрогены являются анаболиками,
стимулирующими остеоформацию. У мужчин со сниженной'функцией гонад замещающая
терапия тестостероном существенно увеличивает скелетную массу. Подобные
результаты получены и при использовании андрогенов у женщин после наступления
менопаузы, однако побочные эффекты (гирсутизм, угри, временное облысение
и другие признаки вирилизации) ограничивают применение этих препаратов.
22. Насколько эффективна
терапия гормоном роста и инсулиноподобным фактором роста 1?
Гормон роста — это еще один
анаболический агент, который способствует остеофор-мации. Очень полезное
при дефиците гормона роста, это средство эффективно также при остеопорозе
после наступления менопаузы и при сенильном остеопорозе. Терапия гормоном
роста дорогостояща и вызывает осложнения, к которым относятся синдром акромегалии,
гипергликемия и артериальная гипертензия. Исследования с инсулиноподобным
фактором роста 1 (IGF-1) начались недавно, но предварительные результаты
подтверждают его полезное действие на костное ремоделирование.
23. Как происходит увеличение
костной массы при терапии паратиреоидным гормоном?
Остеобласты имеют на поверхности
рецепторы для паратиреоидного гормона, у остеокластов таких рецепторов
нет. Паратиреоидный гормон первоначально стимулирует остеобласты, секретирующие
цитокины и другие факторы, которые, в свою очередь, стимулируют остеокласты.
Паратиреоидный гормон, вводимый подкожно, больше способствует остеоформации,
чем резорбции, и это приводит к прогрессирующему увеличению костной массы.
Такая терапия в настоящее время стоит дорого, но в связи с многообещающими
начальными результатами этот препарат активно изучается.
24. На каких принципах
основано лечение фосфатом, принимаемым внутрь?
Фосфат, принимаемый внутрь,
стимулирует интермиттирующую секрецию эндогенного паратиреоидного гормона,
который, подобно инъекционной форме, может больше стимулировать остеоформацию,
чем резорбцию. Нет убедительных доказательств того, что монотерапия фосфатом
эффективна, но это средство способно оказаться полезным при комбинации
с антирезорбтивным препаратом. Сейчас проводятся исследования эффективности
формы фосфата для приема внутрь.
25. Что такое когерентная
терапия?
Когерентная терапия, обозначаемая
также ADFR (аббревиатура от слов активировать [activate], подавлять
[depress], свободный [free], повторный [repeat]) — это схема, в которой
антирезорбтивные препараты сочетаются или чередуются со средствами, стимулирующими
остеоформацию. Самые хорошие результаты получены при сочетании гормона
роста с кальцитонином и чередовании приема фосфата внутрь с этидронатом.
Установлено, что обе схемы имеют минимальное преимущество или вообще не
отличаются по эффективности от монотерапии антирезорбтивным препаратом.
Поэтому, хотя данная концепция остается весьма привлекательной, необходимы
дальнейшие исследования для уточнения ее преимуществ и возможного более
широкого распространения.
Избранная литература
Brixen К. et al. A short
course of recombinant human growth hormone treatment stimulates osteoblasts
and activates bone remodeling in normal human volunteers. J. Bone Min.
Res., 5: 609-618,1990.
Chapuy M. C., Ariot M. E.,
Duboeuf F. et al. Vitamin D3 and calcium to prevent hip fractures
in elderly women. N. Engl. J. Med., 327:1637-1642,1992.
Chestnut III C. H., Ivey
J. L., Gruber H. E. et al. Stanozolol in postmenopausal osteoporosis: Therapeutic
efficacy and possible mechanisms of action. Metabolism, 32: 571-580, 1983.
Civitelli R., Gonnelli S.,
Zacchel F. et al. Bone turnover in postmenopausal osteoporosis: Effect
of calcitonin treatment..}. Clin. Invest., 82:1268-1274,1988.
Dawson-Hughes В., Dallal
G. E., Krall E. A. et al. Effect of vitamin D supplementation on wintertime
and overall bone loss in healthy postmenopausal women. Ann. Intern. Med.,
115: 505-512,1991.
Degerblad M., Elgindy N.,
Hall K. et al. Potent effect of recombinant growth hormone on bone mineral
density and body composition in adults with panhypopituitarism. Acta Endocrinol.,
126:387-393, 1992.
Ebeling P. R., Jones J. D.,
O'Fallon W. M. et al. Short-term effects of recombinant human insulin-like
growth factor I on bone turnover in normal women. J. Clin. Endocrinol.
Metab , 77-1384-1387,1993.
Finkelstein J. S., Klibanski
A., Neer R. M. et al. Increases in bone density during treatment of men
with idiopathic hypogonadotropic hypogonadism. J. Clin. Endocrinol. Metab.,
69:776-782, 1989.
Gallagher J. C., Goidgar
D. Treatment of postmenopausal osteoporosis with high doses of synthetic
calcitriol. Ann. Intern. Med., 113:649-655,1992
Harris S. Т., Watts N. В.,
Jackson R. D. et al. Four-year study of intermittent cyclic etidronate
treatment of postmenopausal osteoporosis: Three years of blinded therapy
followed by one year of open therapy. Am. J. Med., 95:557-567,1993.
Hock J. M., Gera I. Effects
of continuous and intermittent administration and inhibition of resorption
on the anabolic response of bone to parathyroid hormone. J. Bone Min. Res.,
7: 65-72,1992.
Johnston C. C. Jr., Miller
J. Z., Slemenda C. W. et al. Calcium supplementation and increases in bone
mineral density in children. N. Engl. J. Med., 327: 82-87,1992.
Kleerekoper M., Mendlovic
D. B. Sodium chloride therapy of postmenopausal osteoporosis. Endocr. Rev.,
14:312-323,1993.
Lufkin E. G., Wahner H. W.,
O'Fallow W. M. et al. Treatment of postmenopausal osteoporosis with transdermal
estrogen. Ann. Intern. Med., 117:1-9,1992.
Marx C. W., Dailcy G. E.
Ill, Chemey C. et al. Do estrogens improve bone mineral density in osteoporotic
women over age 65 ?J. Bone Min. Res., 7: 1275-1279, 1992.
Overgaard K., Hansen M. A.,Jensen
S. В., Christiansen C. Effect of salcatonin given intranasally on bone
mass and fracture rates in established osteoporosis: A dose-response study.
BMJ, 305:556-561,1992.
Pak C. Y. C., Sakhaee K.,
Adams-Huct M. S. et al. Treatment of postmenopausal osteoporosis with slow-release
sodium fluoride. Ann. Intern. Med., 123: 401-408, 1995.
Reis I. R., Ames R. W., Evans
M. C., Gamble G. D., Sharpe S. J. Effect of calcium supplementation on
bone loss in postmenopausal women. N. Engl. J. Med. 328: 460-464, 1993.
Riggs B. L., Melton III L.
J. The prevention and treatment of osteoporosis. N. Engl. J. Med., 327:
620-627,1992.
Silverberg S. J., Shane E.,
Clemens T. L. et al. The effect of oral phosphate administration on major
indices of skeletal metabolism in normal subjects. J. Bone Min. Res., 1:383-388,1986.
Slovik D. M., Rosenthal D.
L, Doppelt S. H. et al. Restoration of spinal bone in osteoporotic men
by treatment with human parathyroid hormone (1-34) and 1,25-dihydroxyvitamin
D. J. Bone Min. Res., 1: 377-381,1986.
Watts N. В., Harris S. Т.,
Genant H. K. et al. Intermittent cyclical etidronate treatment of postmenopausal
osteoporosis. N. Engl. J. Med., 323: 73-79,1990.
ГЛАВА 90. МЕТОДИКИ
РЕАБИЛИТАЦИИ
Douglas E. Hemler, M.D.
1. Какова цель реабилитации
пациентов с ревматическими заболеваниями?
Цель реабилитации — сохранение
или восстановление способности пациента успешно функционировать в личной,
семейной и общественной жизни — путем полноценного развития физического,
психологического, социального, профессионального, непрофессионального и
образовательного потенциалов с учетом физиологических или анатомических
нарушений и имеющихся ограничений.
2. Какие функциональные
способности пациента необходимо учитывать? Оценка физических функций
Анамнез: боли и усталость
(можно использовать шкалы визуальных аналогов)
Физикальное обследование
Мануальное тестирование мышечной
силы
Объем движений (можно использовать
гониометры)
Хождение и ношение грузов
Способность к повседневной
активности
Активность в часы досуга
Профессиональная активность,
включая работу, ведение хозяйства и учебу
Половая активность
Сон Оценка психических/познавательных
функций
Эмоциональное состояние (депрессия,
беспокойство, характер настроения)
Навыки преодоления болезни
Познавательные функции
Согласие с планом лечения
Оценка социальных функций (семья, друзья, общество)
Системы социальной поддержки
Межличностные отношения
Социальная интеграция
Способность исполнять свою
социальную роль
Положение в семье
Социоэкономические/финансовые
факторы
3. Что необходимо учитывать
для быстрой оценки функциональных способностей пациента с ревматическим
заболеванием?
Наиболее важные действия,
которые надо учитывать для быстрой оценки функционального статуса, легко
запомнить, используя мнемонический ключ ADEPTTS — насколько хорошо пациент
"адаптирован" к своей физической недееспособности:
А — Хождение (Ambulation);
D — Одевание (Dressing);
Е — Прием пищи (Eating);
Р — Личная гигиена (Personal
hygiene);
Т — Перемещения (Transfers);
Т — Туалет (Toileting);
S — Сон/сексуальная активность
(Sleeping/Sexual activities).
4. Какие работники здравоохранения
должны способствовать реабилитации пациентов с ревматическими заболеваниями?
Какие методики реабилитации они используют?
Физиотерапевт — лечит
пациентов и инструктирует их по использованию различных терапевтических
и обезболивающих методик, включающих тепло, холод, диатермию, электростимуляцию,
лечебную физкультуру, ходьбу, упражнения с грузом и разработку движений,
функции и силы суставов.
Терапевт профпатолог —
отвечает за оптимизацию функций пациента, инструктируя его по вопросам
защиты суставов и сохранения энергии. Кроме того, данные специалисты разрабатывают
и предоставляют больным адаптирующее оборудование и шины, особенно для
восстановления функциональной активности верхних конечностей. Обеспечением
пациентов ортопедическими устройствами для нижних конечностей чаще занимаются
подиатристы.
Социальные работники и
консультанты по реабилитации — помогают в решении социальных, экономических
и психологических проблем, создающих стрессовые ситуации для пациента и
его семьи. Сюда может входить помощь в организации отдыха, а также в межличностных
и сексуальных отношениях пациента.
Психотерапевты — помогают
пациентам разрешить их психологические проблемы, связанные с болями и потерей
функции суставами.
Консультанты по вопросам
профессиональной подготовки — способны мобилизовать ресурсы общества
для переобучения и восстановления способности пациента работать.
Медицинские сестры по
реабилитации и специалисты по обучению — ассистируют врачам в инструктировании
пациентов с ревматическими заболеваниями. Предоставляют информацию, наблюдают
и обеспечивают эмоциональную поддержку пациентам и их семьям.
НАГРУЗКА И ПОКОЙ
5. Назовите три формы
покоя.
Покой у пациентов с артритом
может применятся для временного обездвиживания воспаленного сустава, сохранения
энергии или, при определенной патологии, для снижения СОЭ и активности
креатинкиназы.
• Локальный покой обеспечивается
какому-либо суставу с использованием ши-нирования для уменьшения боли,
воспаления или предупреждения развития контрактуры.
• Общий покой используется
на период до 4 нед, если соответствующая противовоспалительная терапия
и амбулаторная реабилитация не эффективны в устранении проявлений ревматоидного
артрита или полимиозита.
• Кратковременный покой
становится
все более популярным, особенно у пациентов с ревматоидным артритом. Это
профилактический способ лечения воспаления и усталости. При этом пациент
чередует свою повседневную активность длительностью более 30 мин с короткими
периодами отдыха.
6. Какова польза физической
нагрузки при артрите?
Утомляемость, слабость и
снижение силы или выносливости являются типичными симптомами у пациентов
с ревматическим заболеванием. Чрезмерный покой и отсут-
ствие активности могут быть
основной причиной снижения мышечной силы. До 30 % мышечной массы и 5-10
% силы могут быть утрачены в течение одной недели иммобилизации сустава.
Кроме того, неподвижность сустава способствует образованию контрактуры
с уменьшением или потерей движений в нем. Целями и полезными эффектами
лечебной физкультуры у пациентов с артритами являются:
• сохранение или улучшение
объема движений в суставе;
• профилактика или уменьшение
контрактур;
• увеличение мышечной силы;
• улучшение выносливости;
• сохранение минерализации
костей;
• увеличение функциональных
способностей;
• улучшение общего самочувствия.
7. Какие факторы учитывают
при выборе программы физической нагрузки для пациента с ревматическим заболеванием?
• Стадия заболевания.
• Степень воспаления и деформации.
• Общее медицинское состояние
пациента.
• Виды активности, привычные
для пациента (для улучшения их переносимости).
8. Назовите три типа физической
нагрузки.
1. Пассивная — движения
выполняются терапевтом или механическим устройством без участия пациента.
2. Активная — движения
выполняет сам пациент.
3. Активно-ассистируемая
—
пациент двигает конечностями с помощью специалиста.
9. Каков минимальный объем
движений каждого сустава, позволяющий пациенту адекватно действовать в
повседневной жизни?
|
|
|
|
|
|
СУСТАВ
|
ОБЪЕМ ДВИЖЕНИЙ
|
|
|
|
Височно-нижнечелюстной
|
2,5 см открытия
челюсти
|
|
|
|
Плечевой
|
Сгибание
45', приведение 90', наружная ротация 20'
|
|
|
Локтевой
|
Сгибание
70'
|
|
|
|
Запястный
|
Тыльное сгибание
5-10', супинация 10-15'
|
|
|
|
Метакарпо-фаланговый
|
Сгибание
> 30'
|
|
|
|
Проксимальный
межфаланговый
|
Сгибание
> 30'
|
|
|
|
Дистапьный
межфаланговый
|
Сгибание
> 30'
|
|
|
|
|
Внутренняя
ротация > 30'
|
|
|
|
Тазобедренный
|
Разгибание
0', сгибание 30'
|
|
|
|
Коленный
|
Сгибание
60'
|
|
|
|
Голеностопный
|
Подошвенное
сгибание 20', тыльное сгибание
|
10'
|
|
|
|
|
|
|
(По: Hicks J. Е. Exercise in patients
with inflammatory arthritis and connective tissue disease. Rheum. Dis.
Clin. North Am., 16: 845, 1990.)
10. Какие виды активной
физической нагрузки используют для увеличения мышечной силы и выносливости
у пациентов с артритом?
1. Изометрическая нагрузка.
Статическое
мышечное сокращение, при котором длина мышцы не изменяется и конечность
не двигается. Рекомендуется от двух до шести сокращений каждой мышцы с
длительностью каждого сокращения по 3-6 с и периодами отдыха между сокращениями
20-60 с. Такая форма нагрузки особенно хороша для сохранения или увеличения
мышечной массы и силы без прогрессирова-ния воспаления сустава у пациентов
с активным артритом.
2. Изотоническая нагрузка.
Динамическое
мышечное сокращение с движением конечности против фиксированного сопротивления.
Такую нагрузку следует давать при достижении контроля над воспалительным
процессом в суставе. Изотоническая нагрузка начинается с массы 450-900
г. Прежде чем увеличивать нагрузку, пациент должен научиться спокойно выполнять
это упражнение 12 раз.
3. Изокинетическая нагрузка.
Скорость
движений постоянная, но сила, прилагаемая пациентом, может различаться
во время движения конечности. Такая форма нагрузки редко используется при
реабилитации пациентов с артритом.
4. Аэробная и водная программы
нагрузки.
11. Чем отличается тренировка
силы от тренировки выносливости?
Сила увеличивается путем
изометрической и изотонической нагрузки с повышенным сопротивлением, приводящим
к меньшему количеству повторений упражнения (7-10). Выносливость увеличивается
посредством изотонической нагрузки с низким сопротивлением, позволяющим
повторять упражнение многократно (трижды по 10 раз).
12. Какие аэробные виды
активности пациентов с ревматическим заболеванием способствуют тренировке
сердечно-сосудистой системы?
Плавание, ходьба, стационарная
велоэргометрия и тредмил рекомендуются для тренировки сердечно-сосудистой
системы. Интенсивность нагрузки должна быть достаточной для учащения сердечного
ритма до 75 % от максимального (220 - возраст) в течение 20-40 мин.
13. Насколько часто пациент
с артритом должен делать физические упражнения?
Ежедневно всем пациентам
с артритами следует выполнять вытяжение конечности в течение 10 мин и движения
в суставе. Пациенты с активным воспалением сустава или относящиеся к функциональным
классам Ill-TV должны также выполнять изометрические упражнения и водные
процедуры по 30 мин 3-4 раза в неделю. Пациенты с контролируемым патологическим
процессом и относящиеся к функциональным классам I-II должны выполнять
изотоническую нагрузку и аэробные упражнения по 30 мин 3-4 раза в неделю.
Особое внимание следует уделять укреплению плечевой и коленной мускулатуры.
14. Как пациент с артритом
может определить, что ему дают слишком большую нагрузку?
• Сильная боль при выполнении
упражнения.
• Усталость после нагрузки
сохраняется более 1 ч.
• Болезненность после нагрузки
сохраняется более 2 ч.
• Усиление боли в суставе
или дрожание конечности на следующий день после нагрузки.
15. Какие меры предосторожности
необходимы перед назначением пациенту тренировок с изометрическими нагрузками?
Изометрические упражнения,
особенно для верхних конечностей, увеличивают системное периферическое
сосудистое сопротивление. Они относительно противопока-
заны пациентам с тяжелой
гипертензией, выраженными сердечно-сосудистыми или цереброваскулярными
заболеваниями.
ФИЗИОТЕРАПИЯ
16. Какие физиотерапевтические
процедуры используются для лечения мышечно-скелетных болей? Термальные
агенты
Поверхностное влажное или
сухое тепло
Глубокое прогревание ультразвуком
или диатермией
Криотерапия Электротерапия
Чрескожная электрическая
стимуляция нерва
Ионофорез Вытяжение
17. Какова основная цель
физиотерапии при артрите?
Уменьшение боли, чтобы пациент
мог заниматься лечебной физкультурой.
18. Какие методы используются
для поверхностного и глубокого прогревания при мышечно-скелетных нарушениях?
Поверхностное прогревание
включает влажное тепло, продуцируемое горячими пакетами, парафиновыми ваннами
или нагретой водой, и сухое тепло (флюидотера-пия). Такое тепло проникает
в ткань только на глубину 1 -1,5 см, и этот эффект длится в течение 30-45
мин.
Глубокое прогревание осуществляется
ультразвуком или коротковолновой диатермией. Ткани на глубине 3-6 см нагреваются
до 41 °С. Эффект сохраняется в течение 30-45 мин, и в это время пациент
может выполнять тренировочные упражнения.
19. Каковы терапевтические
эффекты теплового лечения?
При нагревании тканей одновременно
появляются несколько эффектов: удлинение сухожилия и увеличение растяжимости
суставной капсулы, уменьшение мышечного спазма, аналгезия, увеличение кровотока
и тканевого метаболизма. Поверхностные суставы обычно легче нагревать компрессами,
парафином, флюидотерапией, нагретой водой и тепловым излучением. Тепловая
терапия может использоваться для паллиативного уменьшения болей и спазма,
особенно при подострых и хронических состояниях. Для восстановления функции
поверхностное и глубокое прогревание применяют в комбинации с обычной терапией
и лечебной физкультурой. Увеличение объема движений в суставе происходит
за счет снижения плотности сухожилия и суставной капсулы и уменьшения контрактуры.
20. Имеются ли противопоказания
к тепловой терапии?
Боль и повреждение тканей
начинаются при их нагревании до 45 °С. При возрастании внутрисуставной
температуры увеличивается коллагенолиз. Хотя возможно появление побочных
эффектов при нагревании воспаленных тканей у пациентов с ревматоидным артритом,
увеличения степени деструкции сустава после тепловой терапии не обнаружено.
Боль является важным предупреждающим
признаком повреждения тканей, поэтому противопоказано нагревание участков
тела, лишенных чувствительности, и вы-поление этой процедуры у пациентов
со сниженным умственным развитием. К другим противопоказаниям относятся
повышенная кровоточивость тканей, злокачественные новообразования и опухолевый
процесс. Также следует избегать нагревания области гонад и плода. Участки
с плохой васкуляризацией не должны подвергаться прогреванию вследствие
нарушения распространения в них тепла или возможности увеличения метаболических
потребностей. Нельзя использовать глубокое прогревание при наличии в этой
области имплантированных металлических конструкций.
21. Как проводится криотерапия?
Криотерапия осуществляется
путем местного применения охлаждающего при испарении спрэя, местного массажа
или наложения холодного компресса. Можно использовать общее воздействие
холода посредством погружения конечности в ледяную воду, применения пузырей
или термальных одеял, контрастных ванн. При подо-стрых болях и спазме мышц
спины криотерапия обычно проводится в виде массажа со льдом или наложения
пакета со льдом. Криотерапия — метод выбора при острых повреждениях, особенно
в комбинации с компрессией.
22. И поверхностное тепло,
и криотерапия уменьшают мышечный спазм. Чем отличаются механизмы действия
тепла и холода?
Холод оказывает непосредственное
действие на мышцу, мышечные волокна и сенсорную оболочку мышечных веретен.
Тепло
воздействует
на мышечный спазм прежде всего косвенно — путем торможения активности вторичных
афферентных волокон, увеличения активности аппарата Гольджи (Golgi) в сухожилиях
и снижения активности эфферентных волокон мышечных веретен (у-волокна).
23. Что такое ионофорез?
Это использование прямого
тока для индуцирования проникновения местно аппли-цируемых препаратов в
мягкие ткани и нервы на глубину до 3-5 мм. Наиболее часто для этого применяют
лидокаиновый гель, дексометазоновый гель и аналгетики. Ионофорез назначается
при тендинитах (особенно ахиллова сухожилия), бурситах и невритах.
24. В каких случаях при
патологии шейного и поясничного отделов позвоночника целесообразно применять
вытяжение?
Вытяжение — приложение силы
для растягивания шейных или поясничных позвонков, что увеличивает высоту
межпозвонкового пространства и размер межпозвоночных отверстий. При этом
возрастает объем каналов, в которых проходят нервные корешки. Шейное вытяжение
устанавливается в определенном положении пациента с грузом 10-15 фунтов
(около 4,5-7 кг) и более. Поясничное вытяжение выполняется в лежачем положении
пациента, при этом тазобедренные и коленные суставы согнуты под углом 90°.
Масса груза 40-80 фунтов (около 18-35 кг). Шейное и поясничное вытяжение
дает оптимальный эффект при их выполнении 2-3 раза в день (до уменьшения
или прекращения болей). Отсутствие улучшения в течение 2-4 нед или усиление
боли во время процедуры являются показаниями для прекращения лечения.
ОРТОЗЫ, ПРОТЕКЦИЯ СУСТАВОВ И ВСПОМОГАТЕЛЬНЫЕ
УСТРОЙСТВА
25. Зачем используются
шины и ортозы у пациентов с артритами?
Шины и ортозы используются
в лечении воспалительных и дегенеративных артритов для разгрузки суставов,
обеспечения стабильности отдельных суставов, ограничения или увеличения
объема движений, поддержки сустава в позиции максимального функционирования.
Подобные устройства выпускаются серийно или изготавливаются для конкретного
пациента.
26. Каковы основные причины
несогласия пациентов использовать шины и ор-тозы?
Косметически непривлекательный
вид шины является основным фактором отказа от ее использования. Боязнь
публичного внимания к устройству, включая дискриминацию на работе и в других
условиях, усиливает нежелание пациента применять данный метод лечения.
Если шина существенно облегчает боль или улучшает функцию и если семья
больного или специалисты убеждают в необходимости использования вспомогательного
устройства, пациент обычно становится более уступчив. Косметические шины,
особенно для небольших по размеру пальцев рук, могут конструироваться из
драгоценных металлов и полудрагоценных камней.
27. Что подразумевается под
протекцией суставов?
Методики протекции суставов
и сохранения энергии включают изменение условий работы, разработку/модификацию
условий окружающей пациента среды и его адаптацию к ней. При снижении механического
напряжения сохраняется целостность сустава и уменьшается воспаление. Протекция
суставов включает сохранение объема движений, разгрузку болезненных суставов
и обеспечение адекватных периодов покоя в течение дня.
28. Как использование адаптивных
и мобильных устройств помогает пациенту, страдающему артритом?
Вспомогательные устройства,
замещающие нарушенную функцию, помогают пациенту с артритом сохранять энергию,
уменьшать напряжение суставов, снимать боль и быть более функционально
независимым. Адаптивные устройства для кухни, ванной и для самообслуживания
уже имеются в настоящее время и описаны во многих руководствах для пациентов.
Мобильные устройства включают трости, костыли и коляски.
29. В какой руке следует
держать трость для обеспечения разгрузки больного бедра?
Трость держится противоположной
рукой, что придает руке момент силы, противодействующий весу пациента и
существенно уменьшающий нагрузку на тазобедренный сустав. Трость в руке
на стороне больного бедра фактически увеличивает нагрузку на сустав и усиливает
дискомфорт, боль и суставную дисфункцию. Обратите внимание на то, что при
ходьбе нагрузка на тазобедренный сустав эквивалентна 2-3 весам тела.
30. В какой руке следует
держать трость при патологии коленного или голеностопного суставов?
Ниже уровня бедра нагрузка
на больной сустав снижается более эффективно при расположении трости на
ипсилатеральной стороне. Такое положение трости имеет преимущество при
подъеме и спуске по лестнице, но может препятствовать обычной ходьбе из-за
нарушения естественного направления раскачивания руки. Пациент обнаруживает,
что трость удобнее держать в контралатеральной руке при ходьбе и перекладывать
ее в ипсилатеральную руку при движениях, требующих прямой нагрузки на коленный
или голеностопный суставы. При ходьбе обычная нагрузка на коленный сустав
в 3-4 раза превосходит массу тела, а на голеностопный — в 4-5 раз.
31. Как правильно подобрать
трость или костыли конкретному пациенту?
Правильно подобранная трость
или костыли должны находиться на 20 см латераль-нее плоскости ступни, когда
пациент стоит и держит трость или ручку костыля при согнутом на 15-30°
локте. Такая позиция обеспечивает стабильность в положении стоя, а при
ходьбе позволяет легко упираться тростью или костылем в поверхность впереди
пациента.
РЕАБИЛИТАЦИЯ ПРИ КОНКРЕТНЫХ ЗАБОЛЕВАНИЯХ
32. Назовите общие цели
лечебной физкультуры при остеоартритах.
Помимо прогрессирования локальной
патологии сустава и ослабления непосредственно связанных с ним мышц, у
неактивных пациентов с остеоартритами ухудшается состояние сердечно-сосудистой
системы, уменьшается функциональная независимость и возрастает масса тела.
Ухудшается также способность выполнения повседневной нагрузки. Физические
упражнения как составная часть лечения остеоартри-та используются для уменьшения
этих отрицательных эффектов. Общими целями программы лечебной физкультуры
являются увеличение или сохранение движений в суставе, нормализация способности
ходить, усиление мышечной силы и выносливости, увеличение аэробной мощности,
снижение массы тела, улучшение функциональной способности и обеспечение
возможности социальной обустроенности.
33. Какие виды нагрузки
допустимы пациенту с остеоартритом?
Основываясь на данных об
общей степени дисфункции и локализации пораженного сустава, врач может
назначить лечебную физкультуру, включающую изометрические, изотонические,
аэробные или водные нагрузки. Тип программы необходимо индивидуализировать
для каждого пациента в соответствии с его интересами, способностями и переносимостью
нагрузки. При этом эффективность выполнения физических упражнений возрастает,
когда пациент хорошо понимает их назначение и они одобрены лечащим врачом,
инструкторами группы, другими пациентами и их семьями. Постоянство выполнения
упражнений более важно, чем их интенсивность, особенно когда упражнения
направлены преимущественно на улучшение функционального статуса пациента.
34. Приведите пример лечебной
физкультуры и адаптационной терапии для пациента с ревматоидным артритом,
который недавно перенес обострение, потребовавшее соблюдение постельного
режима в течение 2 нед.
Лечебная физкультура:
оценка
функционального состояния и начало прогрессивной ремобилизации, включая
пассивные и активные методики, ходьбу, инструктирование по технике протекции
сустава для улучшения выносливости, подвижности и уменьшения боли. Эта
программа осуществляется по 1 -2 ч 3 раза в неделю в течение 4-6 нед. Программа
включает также акватерапию для улучшения осанки, ходьбу и силовые упражнения
2 раза в неделю.
Адаптационная терапия:
оценка
текущей функциональной активности и инструктирование по самообслуживанию,
одеванию, ходьбе и личной гигиене. При улучшении состояния — выполнение
работы по дому.
Противопоказания: необходимо
избегать чрезмерного напряжения суставов с остаточным воспалением, снижать
активность при возникновении боли или усталости, обеспечивать адекватные
периоды покоя, не допускать появления тяжелого дискомфорта и боли.
35. Может ли регулярное
выполнение программы физических упражнений улучшить состояние пациентов
с ревматоидным артритом?
Регулярные упражнения могут
увеличивать возможность выполнять физические нагрузки, включая выносливость,
активность в повседневной жизни и мобильность. Программы упражнений должны
специально адаптироваться к определенному патологическому процессу. Пациенты
получают пользу от изотонических упражнений с низким сопротивлением и малым
количеством повторений при короткой амплитуде, составляющей неполный объем
движений. Занятия плаванием, езда на велосипеде, работы в саду и другие
виды активности помогают сохранять и развивать оба вида мышечных волокон
(I и II).
36. Какие методики реабилитации
используют при других ревматических болезнях?
• Анкилозирующий спондилит:
упражнения на растяжение позвоночника и увеличение объема движений тазобедренного
и плечевого суставов. Упражнения с глубоким дыханием.
• Полимиозит/дерматомиозит:
изометрические упражнения 3 раза в неделю после достижения контроля над
воспалительным процессом. Ежедневные упражнения на движения в суставах
для профилактики контрактур.
• Индуцируемая стероидными
гормонами миопатия: активная изометрическая и изотоническая нагрузка задерживает
развитие и уменьшает тяжесть этой миопатии.
• Системный склероз: упражнения
на увеличение объема движений в суставах и шинирование для снижения вероятности
контрактур. Упражнения на сгибание и разгибание пальцев.
• Симпатическая дистрофия:
упражнения для увеличения объема движений в суставах должны быть частью
любой программы. Нередко выполнять упражнения следует только после блокирования
звездчатого ганглия для уменьшения боли.
Избранная литература
Blount W. P. Don't throw
away the cane. J. Bone Joint Surg., 38A: 695-708,1956.
Feinburg J., Brandt K. Use
of resting splints by patients with rheumatoid arthritis. J. Occup. Ther.,
35:173-178,1978.
Guide to Independent Living
for People with Arthritis. Atlanta, Arthritis Foundation, 1988.
Hicks J. E. Exercise in patients
with inflammatory arthritis and connective tissue disease. Rheum. Dis.
Clin. North Am., 16:845-870,1990.
Hicks J. E. Exercise and
rheumatoid arthritis. Arch. Phys. Med. Rehabl., 5: 701-728,1994.
Hicks J. E., Gerber L. H.
Rehabilitation of patients with arthritis and connective tissue disease.
In: DeLisa J. A. (ed.). Rehabilitation Medicine: Principles and Practice,
2nd ed. Philadelphia, J. B. Lippincott, 1993.
Kaul M. P., Herring S. A.
Superficial heat and cold: How to maximize benefits. Phys. Sportsmed.,
22 (12): 65-74,1994.
Melvin J. L. Rheumatic Disease:
Occupational Therapy and Rehabilitation, 3d ed. Philadelphia, F. A. Davis,
1982.
Nicholas J. J., Gwen H. Splinting
and rheumatoid arthritis: 1. Factors affecting patient compliance. Arch.
Phys. Med. Rehabil., 63: 92-94,1982.
Norden D. K., Leventhal L.
J., Schumacher H. R. Prescribing exercise for osteoarthritis of the knee.
J. Musculoskel. Med., 11 (9): 14-12,1994.
Oosterveld F. G. J., Rasker
J. J. Treating arthritis with locally applied heat or cold. Semin Arthritis
Rheum., 24:82-90,1994.
Semble E. L, Loeser R. F.,
Wise С. М. Therapeutic exercise for rheumatoid arthritis and osteoarthritis.
Semin. Arthritis Rheum., 20: 32-40, 1990.
Swezey R. L. Rehabilitation
medicine and arthritis. In: McCarty D. J., Koopman W. J. (eds). Arthritis
and Allied Conditions, 12th ed. Philadelphia, Lea & Febiger, 1993,
887-917.
ГЛАВА 91. ПСИХОСОЦИАЛЬНЫЕ
АСПЕКТЫ РЕВМАТИЧЕСКИХ ЗАБОЛЕВАНИЙ
Elizabeth Kozora, Ph.D.
1. Назовите основные психосоциальные
проблемы, возникающие при ревматических заболеваниях.
• Депрессия и беспокойство.
• Неопределенность и потеря
контроля над патологическим процессом.
• Изменение внешнего облика
и снижение физической активности.
• Снижение самооценки и уверенности
в себе.
• Боязнь стать физически
зависимым и неактивным.
• Потеря профессиональной
независимости, угроза карьере и личной роли в обществе.
• Возрастающий стресс в результате
изменения социального положения и ограниченной подвижности.
2. Имеется ли взаимосвязь
между психологическими факторами и началом болезни?
Нет: в некоторых исследованиях
установлено, что психосоциальный стресс был связан с началом заболевания,
но механизмы такой связи остаются неясными. Весьма вероятно, что заболевание
полиэтиологично, и при стрессе активность болезни может возрастать.
Да: результаты современных
исследований позволяют предположить, что стресс может предшествовать обострениям
ревматических заболеваний, в частности СКВ и ревматоидного артрита. Психосоциальные
стрессорные факторы, например прекращение взаимоотношений с окружающими,
конфликтные ситуации или потеря социальной поддержки, связаны с ухудшением
течения болезни. Не исключено, что стресс приводит к снижению болевого
порога при определенных патологических состояниях.
3. Какие анамнестические
данные позволяют идентифицировать наличие психосоциальных проблем у пациентов
с ревматическими болезнями?
• Психологические проблемы
в анамнезе, предшествующие заболеванию.
• Жалобы пациента на значительное
ухудшение эмоционального или социального статуса, продолжающиеся более
2 нед.
• Длительное отрицательное
и пессимистическое отношение пациента к диагнозу своей болезни.
• Внезапное изменение отношения
пациента к проводимому лечению.
4. Что обусловливает появление
симптомов депрессии при ревматических болезнях?
1. Возрастание тяжести заболевания
и функциональных дефектов.
2. Вторичные последствия
тяжелой болезни могут увеличивать депрессию вследствие безвозвратных потерь
(например, крах карьеры или снижение социальной роли пациента), возрастания
финансовых трудностей и снижения социальной поддержки.
3. Пациенты с низким социально-экономическим
статусом и образованием, как правило, более склонны к депрессии.
4. У больных пожилого возраста
депрессия протекает тяжелее.
5. Хотя и не всегда, но женщины
склонны к более выраженной депрессии.
5. Назовите наиболее важные
симптомы, связанные с депрессией, у пациентов с ревматическими заболеваниями?
Симптомы, характерные для
выраженной депрессии (например, утомляемость, ано-рексия, снижение массы
тела, бессонница, нарушения сна, отсутствие сексуального интереса), могут
наблюдаться как у пациентов с депрессией, так и без нее. Поэтому наличие
симптоматики не всегда свидетельствует о состоянии депрессии у пациентов
с ревматическими болезнями.
Предполагается, что раздражительность,
крикливость, печаль, неудовлетворенность, неуверенность в будущем и трудности
с приемом решений являются нормальными психологическими реакциями на заболевание.
Однако большая длительность периодов таких эмоциональных состояний указывает
на развитие депрессии.
Дополнительные симптомы,
помогающие диагностике депрессивного состояния при ревматических болезнях,
включают:
• ощущение вины;
• пессимизм;
• чувство краха;
• плохой внешний вид;
• низкая самооценка;
• ощущение никчемности;
• ощущение, что болезнь —
это наказание за грехи;
• суицидные мысли.
6. Имеются ли факторы
риска развития депрессивной симптоматики при ревматических болезнях?
• Персональный или семейный
анамнез депрессии до диагностирования ревматического заболевания.
• Возрастание боли и физического
дискомфорта.
• Неудовлетворенность своим
образом жизни.
• Быстрое снижение функциональных
способностей.
• Потеря способности осуществлять
важные для пациента виды деятельности.
7. Что делать для уменьшения
психологических проблем у пациентов с ревматическими болезнями?
• Быть откровенным с пациентом
в вопросах, касающихся природы заболевания, обеспечить его информацией
о болезни и обсуждать методы лечения.
• Любые изменения реакции
на лечение следует обсуждать с пациентом. Например, если пациент не принимал
назначенные лекарственные препараты, необходимо выяснить, почему он не
соблюдал график приема лекарств и были ли побочные эффекты.
• Учитывать факторы, значимые
для пациента, и выяснить, что может сильно повлиять на его самооценку.
Например, если работа является основным делом его жизни, то ее потеря может
потребовать более пристального внимания к нему и дополнительного вмешательства.
• Чрезмерное внимание к пациенту
и увеличение его зависимости от врача иногда имеет вредные последствия
для адаптации к новому образу'жизни.
8. Какие индивидуальные психологические
методики наиболее полезны в коррекции психологических проблем у пациентов
с ревматическими болезнями?
Если у пациента возникают
длительные периоды эмоциональной депрессии, которая мешает повседневной
жизни или полноценному участию в лечении, необходимо предусмотреть консультацию
у психиатра и проведение медикаментозной коррекции. При умеренно выраженных
психологических проблемах целесообразно использовать индивидуальную, семейную
или групповую терапию. При этом обычно используются следующие методики:
1. Поведенческая терапия
направлена на изменения поведенческих аспектов болезни, персонального или
семейного поведения, вносящего вклад в образование вредных для здоровья
привычек.
2. Познавательная терапия
фокусируется на изменении ошибочных или искаженных понятий и мыслей, препятствующих
улучшению здоровья.
3. Релаксирующая терапия
(например биологическая обратная связь, прогрессивная мышечная релаксация)
полезна для уменьшения боли и депрессии.
4. Тренировка навыков преодоления
болезни обеспечивает адаптивный, противодействующий заболеванию стиль поведения
для улучшения способности разрешения проблем.
5. Поддерживающая терапия
уменьшает чувство изоляции и беспомощности, а также способствует "разряжению"
эмоций, связанных с болезнью.
6. Обучение и тренировка
навыков, направленных на информирование и привлечение пациента к участию
в лечении.
9. Какие факторы облегчают
психологическую адаптацию к ревматическому заболеванию?
1. Адекватная социальная
поддержка, удовлетворенность качеством взаимных контактов с другими людьми
и способность преодолеть снижение уровня социального положения.
2. Конструктивная познавательная
оценка болезни и способность воплощать долговременные задачи в реальные
результаты.
3. Использование активной
стратегии преодоления болезни, включающей поиск информации о заболевании,
сосредоточение на позитивных мыслях и формирование персонального представления
о болезни.
4. Упорство, независимость,
внутренний контроль, созидательность, агрессивность и моральная устойчивость.
5. Формирование более широкой
шкалы ценностей с подчинением физических факторов другим ценностям.
6. Получение доходов от альтернативных
финансовых источников и сохранение гибкого графика работы.
10. Как социальные факторы
влияют на реабилитационный процесс, связанный с функциональной несостоятельностью
и болями?
Высокий уровень образования
является преимуществом, которое обеспечивает некоторым пациентам большую
гибкость при выборе новой работы.
Снижение дохода, связанное
с функциональной несостоятельностью, может драматически воздействовать
на семью, а также на реабилитационный и лечебный процессы. Для людей, попавших
в тяжелое экономическое положение, может потребоваться помощь социальных
служб.
Пациенты, имеющие семью,
легче переносят функциональную несостоятельность вследствие меньшего негативного
влияния социальной отчужденности.
Возраст, в котором началась
болезнь, может быть связан со специфическими фазами развития, которые существенно
влияют на жизнь и склонности пациента.
Медленно прогрессирующие
хронические заболевания отличаются от острой травмы. Как правило, чем больше
ответственности несет пациент за случившееся с ним, тем лучше его состояние
поддается коррекции. При неблагоприятном прогнозе требуется постоянная
переоценка и реадаптация к изменяющемуся (ухудшающемуся) состоянию.
При многих ревматических
заболеваниях нарушения функциональных способностей не заметны для окружающих
(например, боль и скованность при ревматоид-ном артрите), что может неблагоприятно
влиять на процесс реабилитации. Чем лучше пациент сможет приспособить свой
образ жизни и самооценку к нарушенным функциональным способностям, тем
легче он адаптируется к определенным ограничениям.
11. Какова ориентировочная
эффективность терапии при ревматических болезнях?
Эффективность лечения ревматических
заболеваний по результатам длительных наблюдений составляет около 50 %,
что сопоставимо с таковой при других хронических заболеваниях. Медикаментозное
лечение не дает результата у 22-67 % пациентов с ревматической патологией.
Неэффективность физиотерапии составляет 33-66 %.
12. Какие факторы определяют
"податливость" пациентов медикаментозному лечению при ревматических заболеваниях?
Строгое соблюдение схемы
медикаментозного лечения нарушается, когда у пациентов развиваются серьезные
побочные эффекты или если необходим многократный прием препарата в течение
дня, а также при сомнении пациента в полезности назначенного лечения.
Уступчивость пациента возрастает
в следующих случаях:
• пациент и врач имеют согласие
во взглядах на проблемы, заболевание и цели лечения. Совместное обсуждение
течения заболевания и терапии, когда пациент сам участвует в процессе лечения,
возможно, улучшает мотивацию больного и его взаимопонимание с врачом;
• пациент боится симптомов
заболевания и верит, что существует эффективное лечение. Врач должен информировать
пациента о всех аспектах болезни и ее лечения. Это помогает пациенту в
развитии способности планировать свою жизнь, уменьшает состояние неопределенности,
обеспечивает разумное использование имеющихся ресурсов и способствует лучшей
подготовке к возможному снижению его функциональных возможностей;
• используются простые методики
самоконтроля, а социальная поддержка достаточна. Сотрудничество со стороны
пациента и членов его семьи;
• заболевание началось недавно,
и назначенный режим лечения не нарушает обычный распорядок повседневной
жизни.
13. Влияют ли ревматические
заболевания на сексуальность?
При многих ревматических
заболеваниях сексуальные функции нарушаются вследствие как самой болезни,
так и действия лекарственных препаратов. Сексуальные проблемы могут появляться
при наличии болей, дискомфорта, повышенной утомляемости, низкой самооценки
или побочных эффектов медикаментозной терапии. У полового партнера пациента
также может возникнуть боязнь секса (например, из-за страха быть слишком
требовательным к больному, причинить ему боль); изменения сексуальной функции
способны внести вклад в эмоциональный дискомфорт. Врач должен оценить изменения
сексуальной сферы путем откровенного обсуждения этого вопроса и, при необходимости,
назначить соответствующее лечение (например, психотерапию).
14. Могут ли лекарственные
средства, используемые при ревматических болезнях, влиять на психические
функции?
Лечение кортикостероидными
препаратами наиболее часто связывают с возникновением психических расстройств
(психоз, эйфория и депрессия). Кроме того, они могут вызывать нарушения
познавательной функции. Связь между дозой кортикосте-роида и реакцией человека
выявлялась не всегда — имеют место значительные индивидуальные различия.
При больших изменениях дозы преднизона (уменьшении или увеличении) необходимо
следить за возможным развитием нарушений психической или познавательной
функций.
Психологические изменения,
связанные с другими антиревматическими препаратами, встречаются редко,
хотя отдельные случаи описаны в литературе. Например, НПВС могут
вызывать головокружение, головные боли, паранойю, депрессию, враждебность
по отношению к окружающим. Лечение препаратами золота и хлорохином может
стать причиной спутанности мышления, галлюцинаций, бреда и ночных кошмаров.
Метотрексат
в
высоких дозах вызывал возникновение поведенческих нарушений.
Избранная литература
Ahles Т. A., Khan S., Yunus
М. В. et al. Psychiatric status of patients with primary fibromyalgia,
patients with rheumatoid arthritis, and subjects without pain: A blind
comparison of DSM-III diagnosis. Am.J. Psychiatry, 148:1721-1726, 1991.
Bauman A., Barncs C., Schrieber
L. et al. The unmet needs of patients with systemic lupus erythematosus:
Planning for patient education. Patient Educ. Counseling, 14:235-242,1989.
Burckhardt C. S., Archenholtz
В., Bjelle A. Quality of life of women with systemic lupus erythematosus:
A comparison with woman with rheumatoid arthritis. J. Rheumatol., 20: 977-981,1993.
Feinblatt A., Anderson F.
S., Gordon W. Psychosocial and vocational considerations. In: Leek J. C.,
Gershwin M. E., Fowler W. M. (eds). Principles of Physical Medicine and
Rehabilitation in the Musculoskeletal Diseases. Orlando, FL. Grime &
Stratton, 1986,217-234.
Hudson J. I., Goldenberg
D. L., Pope H. G. et al. Comorbidity of fibromyalgia with medical and psychiatric
disorders. Am. J. Med., 92: 363-367, 1992.
Katz D., Yelin E. H. The
development of depressive symptoms among women with rheumatoid arthritis.
Arthritis Rheum., 38: 49-56,1995.
Liang M. H., Rogers M., Larsen
M. et al. The psychosocial impact of systemic lupus erythemato-sus and
rheumatoid arthritis. Arthritis Rheum., 27: 13-19, 1984.
Liang M. H. Psychosocial
management of rheumatic diseases. In: Kelly W. M., Harris E. D., Ruddy
S., Sledge C. B. (eds). Textbook of Rheumatology, 4th ed. Philadelphia,
W. B. Saunders, 1993.
Milgrom H., Bender B. G.
Psychological side effects of therapy with corticosteroids. Am. Rev. Respir.
Dis., 147: 471-472,1993.
Moran M. G. Psychological
factors affecting pulmonary and rheumatological diseases. Psychosomatics,
32:14-23,1991.
Rodin G., Graven J., Littlefield
C. Depression in the Medically 111. New York, Brunner/Mazel, 1991.
Young L. D. Psychological
factors in rheumatoid arthritis. J. Consult. Clin. Psychol., 60: 619-627,1992.
ГЛАВА 92. ХИРУРГИЧЕСКОЕ
ЛЕЧЕНИЕ РЕВМАТИЧЕСКИХ
ЗАБОЛЕВАНИЙ
John A. Reister, M.D.
1. Каковы основные показания
к протезированию сустава у пациентов с артритом?
Боль и/или потеря функции,
рефрактерные к медикаментозной терапии. Снятие боли является наиболее достижимым
результатом хирургического вмешательства. Восстановление движений и функции
менее предсказуемо.
2. Какие медицинские факторы
необходимо учитывать перед проведением тотальной артропластики?
У всех кандидатов на ортопедическую
реконструктивную операцию собрать анамнез и провести тщательное физикальное
обследование для оценки общего риска вмешательства. Необходимо выявить
у пациента наличие кариозных зубов, кожных язв (особенно на ногах) и симптомов
инфекции мочевыводящих путей или простатита, так как их присутствие увеличивает
риск возникновения послеоперационных инфекционных осложнений. Женщинам
следует выполнить посев мочи для исключения бессимптомной бактериурии.
Если пациенты получают НПВС, их отменяют за
несколько дней (по крайней
мере за 5 периодов полувыведения препарата из организма) до операции для
профилактики кровотечения вследствие антитромботичес-кого действия.
3. Какие еще факторы и
наличие какой патологии могут повлиять на исход операции у пациентов с
ревматоидным артритом?
Шейный отдел позвоночника:
нестабильность
шейного отдела позвоночника вследствие суставной патологии создает риск
неврологических осложнений при интубации. Поэтому перед операцией обязательно
проведение латеральной радиографии в состоянии сгибания и разгибания шейного
отдела.
Височно-нижнечелюстной
артрит (особенно у пациентов с ювенильным ревматоидным артритом) и
крико-аритеноидный артрит затрудняют проведение интубации.
Иммунный статус: частота
инфекционных осложнений существенно выше у пациентов с ревматоидным артритом,
частично вследствие патологического процесса, частично из-за иммуносупрессивной
терапии. Поэтому у пациентов, которым планируется хирургическое вмешательство,
доза кортикостероидов должна быть снижена до минимума. Рекомендуется также
не принимать метотрексат в течение одной недели до и после операции (спорно).
Питание: пациенты
с ревматоидным артритом могут быть относительно истощены, что предрасполагает
к возникновению у них инфекции. Пациенты, у которых общее содержание лимфоцитов
> 1500/мм3 и концентрация альбумина > 3,5 г/дл, менее подвержены
возникновению инфекционных осложнений.
Гипоталамо-гипофизарно-адреналовая
система: пациенты, получающие постоянную кортикостероидную терапию,
не способны адекватно реагировать на стресс, связанный с хирургическим
вмешательством. В таких случаях необходимо назначение повышенных доз кортикостероидов
до, во время и после операции.
4. У пациентов с ревматоидным
артритом часто поражены несколько суставов. Какая рекомендуется последовательность
реконструктивных вмешательств?
Хирургическое вмешательство
на нижних конечностях выполняется в первую очередь (до реконструкции верхних
конечностей), так как после операции требуется использование костылей.
При множественном поражении
суставов ног реконструктивная операция на тазобедренном суставе выполняется
раньше, чем на коленном. Это обеспечивает лучшее выравнивание колена. Кроме
того, процесс реабилитации после операции на тазобедренном суставе несколько
проще, чем после протезирования коленного.
При патологии верхних конечностей
преимущественная последовательность реконструктивных операций не установлена.
Обычно начинают с коррекции прокси-мальных суставов, нервов и сухожилий,
затем оперируют кисть и запястье. Реконструктивная операция на запястье
осуществляется раньше, чем на кисти. При поражении плечевого и локтевого
суставов первым оперируют тот сустав, поражение которого определяет большую
часть симптоматики.
5. Какие дополнительные
средства используются во время и после тотальной арт-ропластики тазобедренного
и коленного суставов для предупреждения послеоперационных осложнений?
Интраоперационно для снижения
вероятности развития инфекционных осложнений профилактически назначают
антибиотики. Для профилактики послеоперационного тромбоза глубоких вен
нижних конечностей применяются специальные чулки, ранний подъем больного
и ходьба, антикоагулянты. Без послеоперационной анти-коагулянтной терапии
(обычно в течение 3-6 нед) тромбоз глубоких вен развивается у 50-60 % пациентов,
при этом эмболия легочной артерии, приводящая к гибели больного, отмечается
в 1-3 % случаев.
6. Что такое "правило
третей" Стила (Steel)?
На уровне первого шейного
позвонка (Q) его переднезадний диаметр разделяется на трети: Уз для одонтоида,
'/3 Для спинного мозга и '/з для свободного пространства. Так
как на этом уровне имеется значительное свободное пространство, небольшие
подвывихи CI-M (3-8 мм) обычно не повреждают спинной мозг. Однако если
передний атланто-одонтоидный интервал (измеряемый от задней части передней
арки Ci до передней границы одонтоида) увеличивается более чем на 10-12
мм, весь атланто-аксиальный связочный аппарат оказывается разрушенным,
и в таких случаях анатомия спинномозгового пространства обычно изменяется.
Аналогично, если задний атланто-одонтоидный интервал (измеряемый от задней
границы одонтоида до передней части задней арки Q) увеличивается более
чем на 14 мм, спинной мозг обычно сдавливается. (См. также главу 18.)
7. Когда необходимо проводить
хирургический артродез Ci_n у пациентов с рев-матоидным артритом?
Ответ на этот вопрос неоднозначен.
Сильные боли, миелопатические симптомы и/или базальная инвагинация > 5
мм, определяемая при латеральной радиографии шейного отдела позвоночника,
являются показаниями к хирургическому лечению. Недавно рекомендовано осуществлять
профилактический артродез независимо от симптоматики и неврологических
нарушений у пациентов с передней нестабильностью Ci_n и задним атланто-одонтовидным
интервалом, равным 14 мм и менее.
8. Какова частота возможных
интра- и послеоперационных осложнений после артродеза шейных позвонков
у пациентов с ревматоидным артритом?
• Послеоперационная смертность:
0-10 %; у пациентов с тяжелыми неврологи-• ческими нарушениями может достигать
33 %.
• Инфицирование раны, образование
свища: до 25 % в прошлом, в настоящее время значительно меньше.
• Несращение позвонков: 0-50
%, в среднем 20 %.
• Поздний субаксиальный подвывих
ниже места предшествующего артродеза вследствие повышенных нагрузок на
позвоночник.
9. Назовите виды хирургических
вмешательств при патологии плечевого сустава у пациентов с ревматоидным
артритом.
Хирургические вмешательства
на плечевом суставе осуществляются, прежде всего, для уменьшения болевого
синдрома. При этом обычно не наблюдается увеличения объема движений. Протезирующая
артропластика может включать весь сустав (плечевая артропластика) или только
головку плечевой кости (гемиартропластика). Определяющим моментом при выборе
той или иной операции является состояние влагалища мышцы-ротатора. Для
максимального функционального использования и стабильности тотальной плечевой
артропластики напряжение мягких тканей при нормальном состоянии влагалища
мышцы-ротатора играет существенную роль.
Если влагалище мышцы-ротатора
патологически изменено и его невозможно исправить, то выполняется сокращенная
артропластика, или гемиартропластика.
10. Каковы возможности
хирургического лечения артрита локтевого сустава? При воспалителении
этого сустава, рефрактерном к медикаментозной терапии, си-новэктомия
способствует временному контролю над течением болезни и устранению боли,
но редко увеличивает объем движений. Синовэктомию часто сочетают с удалением
головки лучевой кости (при ее существенной патологии).
При остеоартрите локтевого
сочленения прежде всего поражается плечелокте-вой сустав, при этом
развиваются остеофиты на короновидном отростке, или олекра-ноне. Эти остеофиты
устраняются путем остеотомии дистального отдела плечевой кости (по Outerbridge-Kashiwagi).
Если суставной хрящ разрушен, суставную поверхность можно закрыть аутологичной
тканью, чаще всего широкой фасцией (fascia /ate).
При посттравматическом
артрите плечелучевого сустава или проксимального лучелоктевого сустава
можно удалить головку лучевой кости (с хорошим результатом) при условии
сохранения интактной коллатеральной связки. Тотальная артропластика локтевого
сустава становится операцией выбора при большинстве артритических поражений
вследствие возрастания надежности современных протезов и значительного
функционального улучшения после операции.
Артродез локтевого сустава
должен быть самым последним средством, так как данная процедура делает
невозможным оптимальное расположение руки для ее функционального использования.
Эта операция осуществляется при инфекционном процессе в суставе, рефрактерном
к терапии, когда тотальное протезирование сустава выполнить нельзя. Артроскопия
используется для диагностики, удаления подвижных частиц и синовэктомии,
выполняемой с целью биопсии и лечения.
11. Каковы методы хирургического
лечения патологии запястья при ревматоид-ном артрите?
При ревматоидном артрите
наблюдается тенденция к поражению мелких суставов кисти и запястья. Запястье
вовлекается в патологический процесс почти всегда, при этом форма поражения
и деформации суставов, как правило, предсказуемы. Цель терапии — устранение
синовита, что позволяет предупредить деструкцию кости и мягких тканей.
При неэффективности терапии восполняют хирургическое удаление воспаленной
синовиальной оболочки или коррекцию деформации.
Дорсальная капсула запястья
и дорсальное сухожильное влагалище обычно вовлекаются в патологический
процесс с развитием синовита и теносиновита, нередко приводящих к разрыву
сухожилия разгибателя. Лучше предупредить разрыв сухожилия, чем потом его
восстанавливать. Поэтому при неэффективности медикаментозного лечения следует
выполнить синовэктомию и теносиновэктомию. Разрыв сухожилий разгибателей
безымянного пальца и мизинца называют синдромом Бона-Джексона (
Vaughn-Jackson). Первичное восстановление сухожилий, как правило, невозможно,
особенно если давность разрыва более нескольких дней. Для восстановления
функции требуется хирургическая пересадка сухожилий.
На ладонной стороне запястья
теносиновит сухожилий сгибателей может вызвать сдавление срединного нерва
в запястном канале, приводя к развитию так называемого запястного туннельного
синдрома. Этот воспалительный процесс иногда вызывает разрыв сухожилия
длинного сгибателя большого пальца, что сопровождается неадекватным сгибанием
большого пальца и переразгибанием межфалангового сустава. Этот комплекс
патологических изменений называют синдромом Маннер-
фельта (Mannerfelt). В данном
случае обычно требуется пересадка сухожилия или артродез межфалангового
сустава большого пальца.
Дистальный лучелоктевой сустав
обычно поражается синовитом, приводящим к нестабильности сустава, деструкции
головки локтевой кости и болезненной ротации предплечья. Головка плечевой
кости начинает выступать в дорсальном направлении, что увеличивает напряжение
сухожилий ульнарных разгибателей. Такое сочетание патологических изменений
называют синдромом головки плечевой кости. Хирургическое лечение синдрома
включает синовэктомию, удаление головки плечевой кости, капсулоррафию и
латеральный тенодез с использованием части сухожилия ульнар-ного разгибателя
запястья.
При поражении лучезапястного
сустава деформация обычно включает следующие пять компонентов: радиальное
смещение, ульнарная девиация, подвывих запястья, межзапястная супинация
и разрушение запястья. В ранние сроки заболевания можно выполнить реконструктивную
операцию — тенодез ульнарного разгибателя запястья. При более выраженных
изменениях для уменьшения болевого синдрома и улучшения функции осуществляется
тотальная артропластика или артродез запястья.
12. Какое хирургическое вмешательство
проводится при базальном остеоартрите большого пальца руки?
Запястно-пястный сустав большого
пальца, также известный как трапецио-метакар-пальный, или базальный сустав
большого пальца, имеет седловидную форму и высокую склонность к дегенеративным
изменениям. В группу повышенного риска развития дегенеративного артрита
этого сустава относят пожилых женщин.
Хирургические вмешательства
включают протезирование сустава, артропласти-ку с сухожильным подвешиванием
и артродез. Протезирование имеет высокий риск неудачи, и в настоящее время
продолжаются интенсивные исследования по разработке протеза лучшей конструкции.
Интерпозиция сухожилия заключается в размещении сухожилия в полости, созданной
путем удаления части или всей трапециевидной кости. Сухожильное подвешивание
осуществляется подобным же образом, однако после удаления трапециевидной
кости создается сухожильная петля, поддерживающая пястное основание большого
пальца, как лямка. Артродез, возможно, является лучшим видом хирургического
вмешательства с точки зрения длительности сохранения положительного эффекта,
но при этом ограничивается метакарпальное движение. Кроме того, во время
операции для обеспечения оптимальной функции необходимо точное позиционирование
костей.
13. Как лечат мукозную кисту
и остеоартрит дистального межфалангового сустава?
Мукозные кисты часто имеют
место при остеоартрите дистальных межфаланговых суставов пальцев. Они выглядят
как светлые, наполненные слизью кисты, располагающиеся обычно между дистальным
межфаланговым суставом и проксимальной частью ногтя. Нередко кисты спонтанно
разрываются, рассасываются и рецидивируют, что ведет к истончению покрывающей
их кожи, увеличивающему риск неудачи при хирургической коррекции.
Мукозные кисты возникают
вследствие хронического воспалительного процесса, вторичного по отношению
к дорсальному остеофиту дистального межфалангового сустава. Поэтому при
обследовании проводится рентгенография, а лечение должно быть направлено
на удаление остеофита. При выраженной болезненности или нестабильности
дистального межфалангового сустава методом выбора является его артродез
с фиксацией в положении умеренного сгибания.
14. Как хирургическим
путем лечатся деформации проксимальных межфаланго-вых суставов у пациентов
с ревматоидным артритом?
Деформации в форме "бутоньерки"
являются
результатом синовита проксимальных межфаланговых суставов, вызывающего
удлинение и разрыв сухожилий разгибателей и ведущего к прогрессирующим
сгибательным контрактурам. На ранних стадиях целесообразно выполнение синовэктомии.
Деформации в виде "лебединой
шеи" в процессе развития проходят четыре стадии. На первых трех стадиях
для их коррекции используются шинирование, си-новэктомия, хирургическое
устранение внутренних мышечных и сухожильных спаек. На последней стадии,
когда проксимальный межфаланговый сустав разрушен, можно только выполнить
его протезирование или артродез.
15. Каковы результаты
хирургической коррекции пястно-фаланговых суставов у пациентов с ревматоидным
артритом?
Синовит пястно-фаланговых
суставов в конечном счете ведет к их деструкции, подвывиху и ульнарной
девиации пальцев. На ранней стадии процесса, до появления радиографической
картины выраженной деструкции и деформации сустава, можно выполнить синовэктомию
(для облегчения болевого синдрома при неэффективности медикаментозной терапии).
Нет доказательств того, что синовэктомия замедляет процесс деструкции сустава,
однако она может отсрочить выполнение протезирования.
Артропластика пястно-фалангового
сустава показана, когда синовит приводит к деструкции суставного хряща,
снижению подвижности, боли, ульнарному смещению, деформации и потере функции.
Наиболее часто используются протезы из силиконовой резины (протезы Свенсона
[Swansea]). К типичным проблемам, связанным с их применением, относятся
поломки, скованность движений, нестабильность и реактивный синовит как
следствие контакта с силиконовыми частицами. Артропластика пястно-фалангового
сустава, независимо от конструкции протеза, обеспечивает объем движений
в 60°, который со временем может уменьшаться до 30°. Послеоперационное
шинирование и реабилитация достаточно сложны и занимают несколько месяцев.
Поэтому для получения оптимального результата требуются взаимопонимание
и терпение.
Артродез обычно не используется,
за исключением пястно-фалангового сустава большого пальца, так как для
этого пальца более важна сила сжатия, чем объем движений.
16. Назовите три симптома,
являющиеся показаниями для протезирования сустава у пациентов с тазобедренным
или коленным артритом.
1. Неспособность пройти более
одного квартала из-за боли в суставах.
2. Неспособность стоять на
одном месте более 20-30 мин вследствие появления боли.
3. Неспособность к полноценному
сну из-за болезненности при движениях во сне.
17. Что означает термин
"низкофрикционная артропластика"?
Джон Чарнли (John Charnley),
зачинатель тотального протезирования суставов, придумал этот термин в 1979
г. при описании своего протеза тазобедренного сустава. Термин относился
к головке бедренного компонента, имевшей небольшой размер (22 мм). Вследствие
малой площади поверхности, объем движений между головкой протеза и полиэтиленовым
углублением был минимальным, что уменьшало повреждение искусственной вертлужной
впадины при трении, снижало вероятность возникновения нестабильности протеза
и изнашивания полиэтиленовой оболочки. В результате уменьшалось количество
искусственных частиц, попадающих со временем в полость протеза. Однако
небольшая бедренная головка концентрировала на себе суставные действующие
силы и со временем все же вызывала деформацию полиэтилена. Поэтому размер
головки в современных протезах составляет 26-28 мм, что уменьшает вероятность
обеих форм изнашивания конструкции.
18. Чем различаются цементированные,
бесцементные и комбинированные протезы?
Эти термины относятся к способам
фиксации тазобедренного или коленного суставных протезов. Наибольший опыт
накоплен с цементированными протезами, в которых используется самозакрепляющийся
акриловый цемент (полиметилметакрилат) для улучшения фиксации компонента
протеза к кости. Современные достижения в разработке методик цементирования
снизили количество проблем, связанных с нестабильностью протеза.
К бесцементным относятся
протезы в виде "насадки" и пористые врастающие протезы. Первые основаны
на удобном закреплении протеза на кости в виде "насадки" без использования
цемента. Поры во врастающих протезах расположены на про-ксимальной части
бедренного компонента и на обратной стороне искусственной вертлужной впадины.
Они способствуют прорастанию кости в протез. Пористое покрытие протеза
может содержать гидроксиапатит или факторы роста для стимуляции прорастания
костной ткани и улучшения фиксации протеза. В целом наблюдается врастание
кости примерно на 10 % площади пористой поверхности протеза.
Бесцементные ацетабулярные
компоненты обеспечивают наилучшее врастание костной ткани в пористые области.
Вследствие этого во многих центрах используется бесцементное крепление
искусственной вертлужной впадины, а бедренный компонент фиксируется цементом.
Такие протезы называют комбинированными.
19. Когда целесообразно
использовать цементированные протезы, а когда — бесцементные?
На этот вопрос существуют
различные взгляды. Более молодые активные пациенты с удовлетворительным
состоянием костей, у которых во время операции можно достичь хорошего соединения
протеза с костью, являются лучшими кандидатами на имплантацию бесцементного
протеза. Они, как правило, моложе 50-60 лет и страдают остеоартритом тазобедренного
сустава. Цементированные протезы обычно используются у пациентов с ревматоидным
артритом и неудовлетворительным состоянием костей, а также у пожилых больных
с низким уровнем активности. Послеоперационная реабилитация проще при имплантации
цементированных протезов по сравнению с бесцементными.
20. Насколько часто возникает
асептическая нестабильность тазобедренного протеза? Каковы ее причины?
Для цементированных протезов,
имплантированных с использованием более старых методик, частота асептической
нестабильности, требующей ревизии, составляла 10-15 % за 10-15 лет наблюдения
(1 % в год). Частота рентгенографических признаков нестабильность бедренного
компонента протеза достигала 30-40 %. При использовании современных хирургических
методик частота этого осложнения составляет < 3 % за 10 лет, что сравнимо
с таковой при пористых бесцементных протезах. Молодые пациенты (возраст
< 50 лет) и лица с избыточной массой тела (> 90 кг) имеют повышенный
риск возникновения нестабильности протеза.
Как правило, нестабильность
обусловлена не нарушением цементного крепления, а накоплением частиц протеза
(полиэтилен, метилметакрилат, металл). Эти частицы стимулируют макрофаги
на границе кости с цементом. Макрофаги продуцируют простагландины и цитокины
(интерлейкин-1 и фактор некроза опухоли), вызывающие резорбцию костной
ткани и нестабильность протеза.
21. Какое типичное осложнение
развивается у пациентов с бесцементными протезами?
Умеренные или сильные боли
в бедре наблюдаются примерно у 20 % пациентов с пористыми тазобедренными
протезами. Боли возникают вследствие реакции кости на напряжение, возникающее
у верхушки бедренной кости. Это состояние обычно не требует специальной
медикаментозной терапии и проходит в течение 12-18 мес.
22. Расскажите о проблемах,
возникающих при ревизии протеза тазобедренного сустава.
Ревизия протеза тазобедренного
сустава технически более сложна по сравнению с первичной артропластикой,
и результат (долговременность) ревизии протеза значительно хуже (короче)
при одновременно большей частоте осложнений. Одной из существенных проблем
является рассасывание костного ствола, чаще возникающее в случае, если
первоначально применялся цемент. Во избежание этого осложнения, в настоящее
время рекомендуется использовать комбинированные протезы. Однако у более
активных пациентов (обычно моложе 60 лет) рекомендуется применять протезы
в виде "насадки" для ограничения рассасывания костного ствола, так как
в будущем, возможно, еще понадобится проведение ревизионной артропла-стики.
23. Используется ли артроскопия
в лечении коленного остеоартрита?
Лечебная артроскопия коленного
сустава показана на ранней стадии остеоартрита, когда симптоматика обусловлена
внутренней патологией, например разрывом мениска. Проведение артроскопии
и/или лаважа может также на несколько месяцев уменьшить боль у некоторых
пациентов с более выраженными дегенеративными изменениями (спорно).
24. В каких случаях вместо
тотального протезирования коленного сустава проводят остеотомию?
У молодых активных пациентов
с артритом, поражающим только один отдел коленного сустава. Высокая большеберцовая
остеотомия является наиболее частой корригирующей операцией на коленном
суставе, в случаях когда дегенеративные изменения ограничены только медиальным
или латеральным его отделами. Вовлечение в патологический процесс пателлофеморального
отдела, воспалительный артрит, значительное снижение объема движений и
пожилой возраст являются противопоказаниями к проведению данной операции.
Это хирургическое вмешательство обычно осуществляется для облегчения боли,
сохранения функционального статуса и отсрочки тотального протезирования
сустава. Операция заключается в выравнивании механической оси (от центра
головки бедренной кости до центра соединения с лодыжкой). Эта ось перемещается
от пораженного отдела сустава к непораженному чаще всего посредством клиновидной
остеотомии большеберцовой кости. Если коррекция механической оси требует
клина > 12°, то остеотомия должна выполняться на дистальной части бедренной
кости, что предупреждает скос линии сустава в латеральную сторону. Наиболее
частыми осложнениями являются недостаточная коррекция и повреждение малоберцового
нерва.
25. Каковы показания к
артропластике одного отдела коленного сустава?
Этот вопрос дискутабелен,
и многие хирурги выступают против выполнения данной операции. Она показана
пожилым истощенным пациентам, ведущим сидячий образ жизни, у которых колено
сгибается по крайней мере на 90° и имеется поражение только одного отдела
сустава. Данная операция противопоказана при воспалительном артрите, ожирении,
молодом возрасте, объеме движений коленного сустава < 90° или 15° сгибательной
контрактуре, вовлечении в процесс пателлофеморального отдела. Операция
включает очищение бедренной и большеберцовой суставных поверхностей пораженного
отдела. Также возможна ревизия сустава для решения вопроса о его тотальном
протезировании, но технически это сделать сложнее, и риск осложнений выше
по сравнению с первичным протезированием.
26. В каких случаях применяется
цементированная тотальная артропластика коленного сустава, а в каких —
бесцементные протезы?
Применение цементированного
заднего стабилизированного мыщелкового протеза и тотального мыщелкового
протеза дает удовлетворительные результаты в 90-95 % случаев при 5-10-летнем
наблюдении при ревматоидном артрите и остеоартрите. Результаты использования
бесцементных протезов неудовлетворительные вследствие плохого прорастания
кости и нестабильности большеберцового компонента. В настоящее время бесцементная
тотальная коленная артропластика, как правило, не используется.
27. Насколько часто развиваются
инфекционные осложнения при тотальной тазобедренной и коленной артропластике?
Частота ранних послеоперационных
инфекционных осложнений обычно < 0,5 % при дооперационном применении
антибиотиков и соблюдении асептики. Поздние инфекционные осложнения (>
1 года после операции) наблюдаются в 1 % случаев при ревматоидном артрите
и еще реже — при остеоартрите.
28. Следует ли пациентам
с суставными протезами профилактически назначать антибиотики перед лечением
зубов?
Да. Амоксициллин, эритромицин,
цефалексин или цефадрин 1000 мг внутрь за 1 ч до и 500 мг через 4 ч после
процедуры.
29. Как лечить инфекционные
осложнения при суставном протезировании? Ранние инфекции (< 2 нед
после операции) лечат антибиотиками и открытой сино-вэктомией, полным удалением
инфицированных тканей с сохранением протеза. При этом обычно требуется
многократная хирургическая обработка раны.
Поздние инфекции обычно
проявляются только болями, но могут протекать с очевидными признаками воспаления
пораженного сустава. Лечение состоит в удалении протеза, полном удалении
инфицированных тканей и внутривенном введении антибиотиков в течение 6
нед. При высеве низковирулентных микроорганизмов через 6 нед можно выполнить
реимплантацию протеза с использованием содержащего антибиотик цемента.
При высеве грамотрицательных микроорганизмов протез удаляется на больший
срок, иногда требуется период до 12 мес для снижения риска повторной инфекции.
30. Какова наиболее частая
этиология артрита голеностопного сустава? Как его лечить хирургическими
методами?
Посттравматический артрит
и ревматоидный артрит. Артрит голеностопного сустава наблюдается гораздо
реже по сравнению с артритом тазобедренного и коленного
сустава, но если он развивается,
это, как правило, связано с посттравматическими изменениями. Переломы,
ведущие к минимальному (1-2 мм) латеральному подвывиху таранной кости,
вызывают дегенеративные изменения в суставе за относительно короткое время
вследствие снижения площади контакта суставных поверхностей и возрастания
действующих сил.
Независимо от этиологии,
необходимо выполнять упражнения, направленные на функциональное укрепление
сустава до тех пор, пока пациент может их переносить. Тотальное протезирование
голеностопного сустава не может быть рекомендовано в качестве средства
выбора, поскольку сопровождается высокой частотой развития инфекции и нестабильности
протеза. Голеностопный артродез в настоящее время является лучшим методом
лечения конечной стадии артрита. Эффективность артроде-за выше при посттравматическом
артрите, чем при ревматоидном, при котором частота инфекционных осложнений
и неполной фиксации сустава минимальна. Ключевым моментом этого хирургического
вмешательства является размещение таранной кости определенным образом под
большеберцовой костью, что облегчает ходьбу, обеспечивает относительно
нормальный шаг и предупреждает переломы плюсневых костей вследствие перенапряжения.
31. Какие суставы скрепляются
при тройном артродезе?
Субтаранный, пяточно-кубовидный
и таранно-ладьевидный суставы. Ревматоидный артрит и ювенильный ревматоидный
артрит поражают субтаранный и предплюсневые суставы. Патология этих суставов
может быть изолированной или комбинированной. Имеется тенденция к выполнению
изолированного артродеза пораженных суставов вместо тройного артродеза
(когда это возможно). Особенно часто наблюдается изолированная деструкция
таранно-ладьевидного сустава. У взрослого пациента с ревматоидным артритом,
рекомендуется в таких случаях выполнять изолированный артродез. Наоборот,
если данное поражение встречается в юном возрасте при ювенильном ревматоидном
артрите, то следует выполнить артродез всего предплюсневого сустава (таранно-ладьевидного,
пяточно-кубовидного), дающий более удовлетворительные отдаленные результаты.
Изолированный субтаранный
артродез обычно выполняется, когда остальные суставы этого тройного сочленения
не участвуют в патологическом процессе и подвижны. Для максимального сохранения
биомеханики при ходьбе тройной артродез требует такого же тщательного расположения
костей, как и артродез голеностопного сустава. При сниженной чувствительности
ног (обычно в результате диабета) артродез противопоказан из-за высокой
вероятности образования кожных язв и их инфи-цирования.
32. Каковы показания к
хирургической коррекции деформации медиальной части большого пальца ноги?
Боль и/или нарушение целостности
кожи, рефрактерные к консервативным методам лечения. Деформация имеет вид
выступа на медиальной стороне стопы на уровне головки первой плюсневой
кости. Термин "вальгусное искривление большого пальца" означает чрезмерное
латеральное отклонение большого пальца дистально к плюсне-фаланговому суставу.
При первом обращении всех
пациентов необходимо лечить консервативно: ношение специальной, более широкой
обуви, имеющей место для выступа на большом пальце, или растяжение имеющейся
обуви. При неэффективности этих мер в течение 2-3 мес планируется хирургическая
коррекция. Имеется несколько хирургических методик операции. Выбор
зависит от степени деформации, соответствия суставных поверхностей первого
плюснефалангового сочленения и наличия дегенеративных изменений сустава.
У пациентов с ревматоидным артритом артродез предпочтительнее реконструкции
мягких тканей и остеотомии. Протезирование сустава, как правило, не обеспечивает
надежного долгосрочного результата. Ювенильная деформация большого пальца
— к сожалению, распространенная патология — вероятность рецидивов после
хирургической коррекции — 50 %.
33. Что такое операция
Клэйтона-Хофмана (Clayton-Hofrman)?
Часто выполняемая корригирующая
операция при выраженной ревматоидной деформации стопы. Ревматоидное поражение
стопы обычно заключается в дегенерации и нестабильности первого плюснефалангового
сочленения, ведущих к вальгус-ному отклонению большого пальца и деформации
его медиальной части. Реже наблюдаются синовиты пальцев ног, приводящие
к подвывихам и, иногда, к вывихам остальных плюснефаланговых суставов.
В результате образуются выступы головок плюсневых костей на подошвенной
поверхности, и развивается устойчивый к лечению подошвенный кератоз. Прогрессирующий
деформирующий процесс обычно вовлекает в той или иной степени все плюснефаланговые
суставы.
Операция Клэйтона-Хофмана
заключается в резекции всех головок плюсневых костей с использованием подошвенного
или дорсального доступов. Изредка патологический процесс затрагивает два
сустава, в таких случаях операцию можно выполнить только на пораженных
сочленениях. Однако не рекомендуется удалять только одну или три головки
пораженных плюсневых костей. Часто вместе с операцией Клэйтона-Хофмана
проводится артродез первого плюснефалангового сустава.
34. Каковы различия между
деформациями пальца по типу "молотка", "когтя" и "колотушки"?
|
ПОЗИЦИЯ СУСТАВА
|
|
|
ДЕФОРМАЦИЯ
ПАЛЬЦА
|
ПЛЮСНЕ-ФАЛАНГОВЫЙ
|
ПРОКС. МЕЖ-ФАЛАНГОВЫЙ
|
ДИСТ. МЕЖ-ФАЛАНГОВЫЙ
|
ХИРУРГИЧЕСКОЕ
ЛЕЧЕНИЕ
|
|
|
"Молоток"
|
Интактный,
нейтральная
|
Сгибание
|
Интактный,
нейтральная
|
Сгибаемый
— перенос сгибателя на разгибатель Фиксированный — гемирезек-ционная артропластика,
удаление дистальной части про-ксимальной фаланги
|
|
|
"Коготь"
|
Фиксированный,
разгибание
|
Фиксированный,
сгибание
|
Интактный,
нейтральная или сгибание
|
Резекция
обеих частей прокси-мального межфалангового сочленения; дорсальная кап-сулотомия
и тенотомия разгибателя; перенос сгибателя на разгибатель
|
|
|
"Колотушка"
|
Интактный,
нейтральная
|
Интактный,
нейтральная
|
Фиксированный,
сгибание
|
Удаление
средней фаланги и/или тенотомия сгибателя при подвижности сустава
|
|
35. Каковы показания к
хирургическому лечению пациентов с симптоматической грыжей диска?
Около 1 % пациентов с грыжей
диска требуют хирургического вмешательства. К абсолютным показаниям относится
грыжа диска, вызывающая синдром "конского хвоста", прогрессирующее сдавление
спинного мозга или выраженную мышечную слабость и прогрессирующие неврологические
нарушения, несмотря на консервативную терапию. Спорными являются показания
к хирургическому вмешательству у пациентов с менее тяжелой симптоматикой.
Относительными показаниями к ла-минэктомии и удалению диска являются непереносимые
боли и симптомы ишиаса, рефрактерные к нехирургическому лечению, с рецидивированием
и
без существенного улучшения, когда пациент не переносит повседневную нагрузку
даже при консервативной терапии в течение 4-6 нед.
Эффективность хирургического
и нехирургического методов лечения ишиаса приблизительно одинакова, но
операция способствует более быстрому уменьшению симптоматики. Наилучшие
результаты хирургического вмешательства наблюдаются у эмоционально стабильных
пациентов с явной грыжей диска, имеющих устойчивую симптоматику, соответствующие
неврологические признаки и у которых наличие грыжи подтверждено радиологическим
исследованием или миелограммой. Наиболее частой причиной безрезультативности
хирургического лечения является плохой отбор пациентов на операцию.
Избранная литература
Ayers D. С., Short W. H.
Arthritis surgery. Clin. Exp. Rheumatol., 11: 75-84, 1993.
Ballard W. Т., CallaghanJ.
J., Sullivan P. M, Johnston R. C. The results of improved cementing techniques
for total hip arthroplasty in patients less than 50 years old: A ten year
follow-up study.]. Bone Joint Surg., 76(A): 959-964, 1994.
Blackburn W. D., Alarcon
G. S. Prosthetic joint infections: A role for prophylaxis. Arthritis Rheum.,
34:110-117,1991.
Boden S. D. Rheumatoid arthritis
of the cervical spine: Surgical decision making based on predictors of
paralysis and recovery. Spine, 19: 2275-2280, 1994.
Cracchiolo A., Cirnino W.
R., Lian G. Arthrodesis of the ankle in patients who have rheumatoid arthritis.
J. Bone Joint Surg., 74(A): 903-908,1992.
Harris W. H., Sledge C. B.
Total hip and total knee replacement (parts I and II). N. Eng. J. Med.,
323:725-731 and 801-807,1990.
Livesley P.J., Doherty M.,Needoff
M. etal. Arthroscopiclavageofosteoarthritic knees. J. Bone Joint Surg.,
738:922-926, 1991.
Mehloff M. A., Sledge С.
В. Comparison of cemented and cementless hip and knee replacements. Arthritis
Rheum., 33:293-297,1990.
Murray D. W., Carr A. J.,
Bulstrode C. J. K. Pharmacological thromboprophylaxis and total hip replacement.
J. Bone Joint Surg., 77(B): 3-5, 1995.
O'DriscollS.W. Elbow arthritis:
Treatment options. J. A. A. O.S., 1(2): 106-116,1993.
Peppelman W. C., Krause D.
R., Donaldson W. F., Agarwal A. Cervical spine surgery in rheumatoid arthritis:
Improvement of neurologic deficit after cervical spine fusion. Spine, 18:
2375-2379,1993.
Weber H. Lumbar disc herniation:
A controlled, prospective study with ten years of observation. Spine, 8:
131-138,1983.
Wroblewski B. Cementless
versus cemented total hip arthroplasty: A scientific controversy. Orthop.
Clin. North Am., 24: 591-597,1993.
ГЛАВА 93. НЕТРУДОСПОСОБНОСТЬ
Scott Vogelgesang, M.D.
1. Что можно предпринять
для пациентов, которые не способны удовлетворительно работать из-за мышечно-скелетных
нарушений?
1. Адаптация рабочего места:
— приобретение или модификация
специального оборудования или устройств;
— модификация рабочего графика;
— изменение характера работы.
2. Рассмотрение вопроса о
смене профессии или переводе на другую работу.
3. Профессиональная реабилитация.
4. Обращение за пособием
по нетрудоспособности.
2. Что означает термин "нетрудоспособность"?
Нетрудоспособность можно
определить как неспособность делать что-либо из-за болезни или повреждения.
Как правило, нетрудоспособность означает для человека экономические потери
вследствие невозможности работать на прежнем уровне из-за изменения его
физического или умственного состояния. В страховых полисах, законах и правилах
термин "нетрудоспособность" имеет более специфическое определение, и его
необходимо отличать от двух других сходных, но не идентичных терминов:
повреждение и гандикап.
3. Дайте специфическое определение
нетрудоспособности.
Нетрудоспособность — это
изменение
способности индивидуума удовлетворять свои персональные, социальные или
профессиональные потребности вследствие повреждения. Это означает,
что существует несоответствие между тем, что индивидуум может делать, и
тем, в чем он нуждается или ч, о он хочет делать. На степень нетрудоспособности
влияет взаимоотношение между индивидуальным повреждением и экономическими
и социальными аспектами жизни индивидуума (возраст, образование, профессиональная
подготовка). Люди с одинаковым повреждением не обязательно имеют одинаковую
степень нетрудоспособности. Нетрудоспособность оценивается с помощью немедицинских
методов.
4. Дайте определение термину
"повреждение".
Повреждение — это физическое
или умственное ограничение нормальной функции
в результате патологического
процесса. Наличие повреждения определяется врачом. Факт существования повреждения
не обязательно означает, что человек нетрудоспособен.
5. Что такое "гандикап"?
Термин "гандикап" относится
к социальным последствиям, связанным с повреждением или нетрудоспособностью.
Гандикап имеется в следующих случаях:
1. Повреждение или нетрудоспособность,
существенно ограничивающие один или более видов повседневной активности
или осуществление обычной для индивидуума деятельности.
2. Наличие медицинской регистрации
данного повреждения.
3. Препятствия выполнению
жизненно важных для человека задач, которые можно преодолеть только посредством
компенсации тем или иным способом воздействия на результаты повреждения.
Такая компенсация включает использование костылей, колясок, протезов и
даже затраты определенного количества времени, необходимого для завершения
выполнения какой-либо задачи.
6. Назовите основные факторы,
определяющие характер нетрудоспособности пациентов с хронической мышечно-скелетной
патологией (или любыми хроническими заболеваниями).
|
|
|
|
|
Заболевание
Тип мышечно-скелетной патологии
Тяжесть заболевания Тяжесть повреждения Личностные факторы Возраст Пол
Образование Личность
|
Работа
Профессия Автономность работы
Опыт Социальные факторы
Социальная поддержка Отношения
и социальные влияния за или против нетрудоспособности
|
|
|
|
|
|
Большинство врачей для снижения
нетрудоспособности пациента концентрируют усилия на смягчении факторов,
определяемых заболеванием. Другие факторы могут быть не менее или даже
более важными в определении того, считает ли пациент сам себя нетрудоспособным.
7. Какие существуют государственные
и социальные программы в отношении нетрудоспособности?
В США приняты две большие
программы, имеющие отношение к нетрудоспособности: Социальная защита по
нетрудоспособности (Social Security Disability) и Компенсация работающим
(Worker's Compensation). Министерство социальной защиты осуществляет две
программы, отличающиеся в основном критерием приемлемости: Социальное страхование
нетрудоспособности (Social Security Disability Insurance [SSDI], также
называющаяся Страховая помощь при нетрудоспособности (Disability Insurance
Benefits) и Дополнительный страховой доход (Supplemental Security Income
[SSI]). Эти программы в настоящее время обеспечивают помощь более чем 4
млн американцев.
8. Расскажите о SSDI.
SSDI — федеральная программа,
разработанная в 1950-х гг. Это самая большая страховая программа нетрудоспособности
в мире. По SSDI наниматели и работники платят в трастовый фонд. Трудящиеся
вносят вклады по определенной таксе (FICA) и получают помощь в соответствии
с размером заработков в специально оговоренных случаях.
Индивидуум оказался неспособным
"заниматься какой-либо приносящей существенный доход работой по причине
установленного медициной физического или умственного повреждения, которое
может привести к смерти или которое сохранялось или может сохраняться в
течение непрерывного периода не менее 12 мес.". При этом ожидается, что
индивидуум не может зарабатывать минимальную зарплату вследствие повреждения.
Министерство социальной защиты пытается учитывать индивидуальные вариации
повреждения, профессиональные и образовательные факторы. SSDI рассматривает
только полную нетрудоспособность, поэтому частичные выплаты не осуществляются.
После получения помощи по SSDI в течение 24 мес. индивидуум может также
квалифицироваться по программе Medicare и получать помощь для покрытия
медицинских расходов.
9. Что такое SSI?
Лица, не попадающие под программу
SSDI из-за отсутствия рабочего опыта, могут получать помощь по программе
SSI, согласно которой выплачивается ежемесячная сумма для покрытия финансовых
расходов. Это относится к пожилым людям старше 65 лет или лицам любого
возраста, имеющим документированную нетрудоспособность. SSI требует оценки
имущества, иногда называемой тестированием "состояния". Как правило, получающим
помощь по SSI часть медицинских расходов оплачивают по Medicaid.
10. Расскажите о программе
компенсации работающим.
Компенсация работающим входит
в расходы, которые оплачивает администрация штата, хотя имеется также программа
для федеральных работников под покровительством Департамента труда США.
Любой работник, получивший заболевание или повреждение во время или вследствие
работы, имеет право на компенсацию финансовых потерь. Это система страховки,
обеспечивающая помощь всем вне зависимости от причины потери трудоспособности
работающим, охваченным этой программой, в случаях, отвечающих определенным
критериям. Такая страховка устраняет необходимость взыскивания денег с
работодателя в судебном порядке. Компенсация работающим эффективна при
производственных травмах, но имеются некоторые сложности ее получения при
профессиональных заболеваниях. За счет компенсации работающим может оплачиваться
частичная нетрудоспособность.
11. К каким категориям
населения применимо понятие "нетрудоспособность"?
• Любой работающий человек
моложе 65 лет.
• Дети в возрасте < 18
лет, не состоящие в браке (допускается возраст 18 лет при посещении высшего
учебного заведения).
• Не состоящие в браке, получившие
нетрудоспособность в возрасте до 22 лет.
• Состоящие в браке, старше
62 лет.
• Состоящие в браке:
— уход за ребенком моложе
16 лет;
— уход за недееспособным
ребенком.
• Нетрудоспособный вдовец
или вдова.
• Нетрудоспособный разведенный(ая)
вдовец или вдова.
12. Какие документы необходимы
для получения помощи по программе SSDI?
• Социальная страховка.
• Свидетельство о рождении
или другой документ, удостоверяющий возраст.
• Формы W2 или документ о
выплатах за прошлый год.
• Документ о местах работы
за последние 15 лет.
• Справка о дате прекращения
работы.
• Свидетельство о браке (если
за помощью обращается супруг или супруга).
• Документ о прохождении
воинской службы.
13. Для тех, кто соответствует
необходимым критериям и представляет требующиеся документы, Министерство
социального страхования выработало 4 основных фактора. Назовите их.
1. Неспособность выполнять
приносящую существенный доход работу. Прибыльной считается работа с оплатой
> $300 в месяц, исключая стоимость рабочих затрат, связанных с нетрудоспособностью
(например приобретение специального оборудования).
2. Рабочие кредиты. Этот
пункт включает длительность рабочего стажа, когда человек был принят на
данную работу и возраст, в котором он стал нетрудоспособным. В настоящее
время работники в возрасте старше 31 года должны сделать взносы в фонд
социального страхования минимум в 20 из предшествующих 40 кварталов. Для
более молодых работников требуется меньшее количество взносов.
3. Тяжесть и объем повреждения.
Требуется объективное подтверждение физического или умственного повреждения,
а наличия только одной симптоматики недостаточно для определения нетрудоспособности.
Необходимы подтверждающие повреждение физикальные, лабораторные и/или рентгеновские
данные.
4. Соответствует повреждение
критериям определения нетрудоспособности, принятым для данного повреждения
или превосходит их. Личный врач пациента не определяет его нетрудоспособность.
Министерство социального страхования имеет список определенных повреждений
для каждой системы организма. Если заболевание пациента отвечает критериям
установления его тяжести, то признается наличие повреждения, вызывающего
нетрудоспособность. Эти списки делают систему определения нетрудоспособности
более объективной и стандартизированной.
14. Что такое "остаточная
функциональная способность"?
Если повреждение у пациента
не соответствует определенным критериям для автоматического установления
нетрудоспособности, врач или специалист по профессиональным заболеваниям,
работающий в Службе определения нетрудоспособности (Social Security Disability
Determination Service), должен вынести заключение об остаточной функциональной
способности. Это понятие определяет степень, до которой пациент сохраняет
свою способность уверенно выполнять физические действия, необходимые для
работы определенного уровня. По физическому уровню работа делится на 5
категорий: сидячая, легкая, средняя, тяжелая и очень тяжелая.
15. Назовите физические требования
к работе для каждой из этих пяти категорий остаточной функциональной способности.
• Сидячая работа:
— сидячее положение;
— поднимание груза массой
< 10 фунтов (4,5 кг);
— редкое (до '/з 8-часового
рабочего дня) поднимание и перенос небольших грузов;
— редкое хождение или стояние;
— отличная сноровка.
• Легкая работа:
— поднимание груза массой
< 20 фунтов (9 кг);
— частые (до 2/з
8-часового рабочего дня) поднимания и перемещение грузов массой < 10
фунтов (4,5 кг);
— частое хождение или стояние;
— сидячая работа с управлением
через рычаги руками или ногами.
• Средняя работа:
— поднимание грузов массой
< 50 фунтов (23 кг);
— частое поднимание и перемещение
грузов массой < 25 фунтов (11 кг).
• Тяжелая работа:
— поднимание грузов массой
< 100 фунтов (45 кг);
— частое поднимание и перемещение
грузов массой < 50 фунтов (23 кг).
• Очень тяжелая работа:
— поднимание грузов массой
> 100 фунтов (45 кг);
— частое поднимание и перемещение
грузов массой > 50 фунтов (23 кг). К другим факторам, учитываемым при определении
остаточной функциональной способности, относятся утомляемость, способность
видеть, слышать и говорить, адекватные умственные способности, возможность
установления социальных контактов с сослуживцами и адаптации к изменениям
в привычном рабочем процессе.
16. Как используется остаточная
функциональная способность в определении нетрудоспособности?
Эксперт по нетрудоспособности
определяет физические требования работы, прежде выполнявшейся человеком,
и оценивает, имеет ли данный индивидуум остаточную функциональную способность
к выполнению этой работы. Если нет, то эксперт устанавливает, возможно
ли в данном случае выполнение какой-либо другой работы в соответствии с
остаточной функциональной способностью, возрастом, образованием и опытом.
Если невозможно, то человек признается нетрудоспособным, даже если повреждение
не соответствует определенным критериям нетрудоспособности.
17. Как оценивается заявление
на помощь по нетрудоспособности? Можно ли оспорить решение?
Заявление в Министерство
социального страхования на помощь по нетрудоспособности сначала рассматривается
врачами-экспертами в отсутствие претендента. Примерно Уз заявлений удовлетворяется.
Однако индивидуум имеет право апелляции, а Министерство социального страхования
такого права не имеет.
После первоначального отказа
претендент может потребовать повторного рассмотрения его заявления другой
группой врачей. Они удовлетворяют, как правило, только 15 % апелляций.
После второго отказа претендент
может обратиться в административно-правовой суд, где впервые может потребоваться
его личное присутствие. Около 60 % случаев обращения к судье удовлетворяются,
что делает эту стадию рассмотрения дела очень важной.
Заявления, не удовлетворенные
в административно-правовом суде, могут быть оспорены в Апелляционном совете
(Social Security Appeals Council) и даже в Окружном суде (США). Немногие
из этих случаев (<5%)ъ конце концов удовлетворяются. В целом
положительные решения принимаются примерно в 50 % всех случаев обращений
в Министерство социального страхования.
18. Если человек, получающий
помощь по нетрудоспособности, возвращается к работе, прекращается ли выплата
ему пособия?
Нетрудоспособные люди продолжают
получать пособие в полном размере в течение 9 мес после возвращения на
работу. Этот срок, называемый испытательным периодом, должен быть
непрерывным, при этом засчитываются только месяцы, в которые человек получает
больше $ 75 (в неделю) или работает более 15 ч.
Необходимость выплаты пособия
по нетрудоспособности оценивается после данного периода. Если принимается
решение, что пособия больше не нужно, оно выплачивается еще 3 мес. В дальнейшем
пособие выплачивается за любой месяц, когда человек нетрудоспособен и не
может выполнять доходную работу в течение 36 мес после окончания испытательного
срока. Если выплата пособия закончилась, а повреждение у индивидуума сохраняется,
помощь Medicare может продолжаться до 39 мес, даже если не выплачивается
пособие по нетрудоспособности.
19. Что такое профессиональная
реабилитация?
Профессиональная реабилитация
— это услуга, предоставляемая по Закону о федеральной реабилитации 1973
г. Образованные правительствами штатов и федерации агентства по профессиональной
реабилитации помогают нетрудоспособным людям найти и сохранить работу.
Каждый штат обязан иметь программу профессиональной реабилитации, хотя
объем помощи различается в отдельных штатах. Частные агентства по профессиональной
реабилитации также обеспечивают большой объем услуг нетрудоспособным и
имеющим повреждения лицам.
Любой человек, заявивший
о своей нетрудоспособности, направляется в агентство по профреабилитации,
где даются консультации, оцениваются интересы и опыт, компенсируются основные
расходы на жизнь, образование, транспортировку, покупку специального оборудования,
обучение и устройство на работу. Агентства могут запрашивать средства и
услуги, оказываемые другими программами. Не все услуги по профессиональной
реабилитации оказываются бесплатно, но если индивидуум очень стеснен в
средствах, расходы оплачиваются полностью. Выплата пособия по нетрудоспособности
может продолжаться в период получения услуг по профреабилитации, но отказ
от получения этих услуг прекращает помощь по нетрудоспособности. Если индивидуум
восстанавливается в ходе получения услуг по профреабилитации, выплата пособия
по нетрудоспособности сохраняется, если оно дает человеку возможность работать.
20. Какова роль врача,
проводящего первичный осмотр, в определении степени нетрудоспособности?
Врач может выполнять несколько
функций.
• Источник информации для
пациента:
— о страховой системе при
нетрудоспособности;
— возможные действия при
отклонении заявления о признании нетрудоспособности.
• Источник для агентства
в документировании повреждения:
— предшествующее состояние
здоровья;
— объективные признаки повреждения
(данные физикального обследования, рентгенография, лабораторные анализы);
— динамика развития симптоматики;
— влияние, которое повреждение
оказывает на повседневную активность пациента;
— реакция на проводимую терапию.
• Защита интересов пациента,
поддержка его в процессе рассмотрения заявления.
• Слежение за процессом лечения.
• Независимое подтверждение
факта повреждения.
• Экспертиза и свидетельство
в случае судебного процесса. Трудности возникают для врача и пациента,
когда эти роли начинают противоречить друг другу. Отношения между врачом,
который пытается быть надежным защитником пациента и в то же время беспристрастным
членом жюри, и пациентом могут стать напряженными.
21. Что такое "повседневная
жизненная активность"?
Это обычная деятельность,
которую необходимо оценить и документировать в процессе определения нетрудоспособности.
Более 60 % пациентов с хронической мы-шечно-скелетной патологией сообщают
о некотором ограничении одного или более видов активности в повседневной
жизни.
Повседневная жизненная активность
|
|
|
|
|
КАТЕГОРИИ
АКТИВНОСТИ
|
СПЕЦИФИЧЕСКИЕ
ВИДЫ АКТИВНОСТИ
|
|
|
Самообслуживание
и персональная гигиена
|
Умывание,
одевание, чистка зубов, причесывание, прием пищи, туалет
|
|
|
Коммуникабельность
|
Письмо, разговор,
слушание
|
|
|
Передвижения,
путешествия, осанка (положение тела)
|
Ходьба, подъем
по лестнице, вождение машины, езда верхом, полеты на самолете, сидение,
стояние, лежание
|
|
|
Подвижность
|
Подъем тяжести,
удержание, тактильное распознавание
|
|
|
Сон, социальная
активность и сексуальные функции
|
|
|
|
|
|
|
22. Применяется ли "Акт
о нетрудоспособных американцах" 1990 г. к мышечно-скелетной патологии?
Да. Этот акт объявляет незаконной
дискриминацию при приеме на работу признанных нетрудоспособными людей.
Он также объявляет вне закона дискриминацию нетрудоспособных в различных
местных учреждениях и учреждениях штатов, по отношению к жилью, транспорту
и телекоммуникациям. Чтобы быть защищенным по этому акту, необходимо иметь
"существенное" повреждение (значительные ограничения и снижение основных
видов жизненной активности) и квалифицироваться как "поддерживающий(ая)
жизненно важные функции и работу с помощью соответствующих приспособлений
или без них".
23. Каково влияние и/или
"цена" мышечно-скелетных нарушений для пациента и общества?
Мышечно-скелетные нарушения
являются наиболее частой причиной хронических проблем со здоровьем, длительной
нетрудоспособности и помещения в учреждения системы здравоохранения. Эта
патология занимает второе место среди ведущих причин обращений в Министерство
социального страхования и получения пособия по нетрудоспособности. Фактически,
более 17 % всех работников, получающих пособие по нетрудоспособности, имеют
мышечно-скелетную патологию.
Цена этого для пациента и
общества огромная. Многочисленные исследования показывают, что снижение
зарплаты имеет гораздо большее экономическое влияние на нетрудоспособного
человека с мышечно-скелетной патологией, чем прямые затраты на медицинскую
помощь и лекарственные препараты, необходимые для лечения заболевания.
Приблизительно 118 млрд долл. "тратятся" ежегодно на медицинскую помощь,
возмещение потерянной зарплаты и компенсацию непроизведенных материальных
ценностей.
Кроме того, пациенты с мышечно-скелетными
заболеваниями составляют 7 % неорганизованной части населения, на них приходится
14 % всех визитов к врачу и 19 % госпитализаций.
Избранная литература
Badley Е. М., Rusooly I.,
Webster G. К. Relative importance of musculoskeletal disorders as a cause
of chronic health problems, disability and health care utilization: Findings
from the 1990 Ontario Health Survey. J. Rheumatol., 21: 505, 1994.
Carey T. S., Hadler N. M.
The role of the primary care physician in disability determination for
Social Security Insurance and Worker's Compensation. Ann. Intern. Med.,
104: 706, 1986.
Liang M. H., Daltroy L. H.,
Larson M. G. et al. Evaluation of social security disability in claimants
with rheumatic disease. Ann. Intern. Med., 115: 26, 1991.
Meenan R. F. Work disability
in rheumatoid arthritis: An approach to the problem. In: Utsinger P. D.
etal. (eds). Rheumatoid Arthritis. Philadelphia,). B. Lippincott, 1985,
829.
Straaton K. V., Harvey M.,
Maijiak R. Factors associated with successful vocational rehabilitation
in persons with arthritis. Arthritis Rheum., 35: 503, 1992.
Yelin E. The economic impact
of arthritis. In: Schumacher H. R. Jr. (ed.). Primer on the Rheumatic Diseases,
10th ed. Atlanta, Arthritis Foundation, 1993, 322.
Yelin E. H., Felts W. R.
A summary of the impact of musculoskeletal conditions in the United States.
Arthritis Rheum., 33:750,1990.
Yelin E. The economic cost
and social and psychological impact of musculoskeletal conditions. Arthritis
Rheum., 38:1351-1362,1995.